- Serina
-
Serina
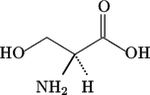
Nombre (IUPAC) sistemático Ácido 2-Amino-3-hidroxipropiónico General Fórmula semidesarrollada C3H7NO3 Fórmula molecular n/d Identificadores Número CAS 302-84-1 Propiedades físicas Estado de agregación Sólido Apariencia Cristales blancos o polvo Densidad 1.603 kg/m3; 0,001603 g/cm3 Masa molar 105.09 g/mol Propiedades químicas Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa serina (abreviada Ser o S)[1] es uno de los veinte aminoácidos componentes de las proteínas codificado en el genoma.
Contenido
Propiedades
El estereoisómero natural es el L. Además de poseer todas la propiedades comunes a los α-aminoácidos, tiene un grupo hidroxilo en la posición 3, por lo que se le clasifica como aminoácido polar. La serina es un aminoácido no esencial, lo que significa que se requiere para el cuerpo humano para funcionar correctamente, pero no tiene que provenir de una fuente externa. En su lugar, se produce típicamente en el cuerpo de metabolitos, como la glicina. Sus codones son UCU, UCC, UCA, UCG, AGU y AGC. Sólo el estereoisómero L aparece de forma natural en las proteínas. La serina se obtuvo por primera vez en 1865 a partir de proteínas de seda, una fuente muy rica en serina. Por lo tanto, su nombre se deriva del latín para la seda, sericum. La estructura de la serina se estableció en 1902.[2]
Catabolismo
La serina puede ser catabolizada ya sea por:
- Amonólisis oxidativa: Se lleva a cabo una eliminación del hidroxilo, tautomería de la enamina a imina y su consecuente hidrólisis para dar piruvato.
- Conversión reversible a glicerato: El paso irreversible del catabolismo por esta vía es la fosforilación del glicerato para dar 3-fosfoglicerato, el cual se puede reincorporar a la glucólisis o a la gluconeogénesis[2]
Biosíntesis
La serina puede ser biosintetizada a partir de varias rutas, pero las dos que dan una biosíntesis neta de serina son:
- A partir del gliceratos: Ya sea a partir del glicerato o del 3-fosfoglicerato (Catabolito de la glucólisis) la serina se puede biosintetizar por dos alternativas: una es oxidando el hidroxilo de la posición 2 del fosfoglicerato, para así formar el piruvato 3-fosfato, la cual se transamina a fosfoserina para posteriormente hidrolizarse; la otra alternativa es oxidar el hidroxilo de la posición 2 del glicerato para dar el 3-hidroxipiruvato, el cual se transamina a serina.
- A partir de la glicina: En plantas, cuando se lleva a cabo la fotorrespiración el cloroplasto absorbe O2, que es catalizado junto con la ribulosa-1,5-bisfosfato (RuBP) por la enzima RuBisCO; transformándola así en ácido glicólico o glicolato. El glicolato es traspasado al peroxisoma (saco membranoso que contiene enzimas) y con la acción de O2, son catalizados por la enzima oxidasa, transformando por una parte en peróxido de hidrógeno y en glioxilato, el que incorpora nitrógeno por transaminación y forma el aminoácido glicina. Dos de estos aminoácidos son llevados a la mitocondria donde finalmente se logran tres compuestos: serina, amoníaco y CO2. Los gases CO2 y amoniaco se liberan. La serina regresa al peroxisoma en donde puede ser utilizada o transformada en glicerato. Éste es llevado al cloroplasto en donde, mediante el gasto de una molécula de ATP, se reintegra al ciclo de Calvin como 3-fosfoglicerato. La glicina, por otro lado, puede ser convertida reversiblemente en serina por acción del N5,N10 tetrahidrofolato (Me=THF) por acción de la glicina hidroximetiltransferasa.[2]
 Resumen biosintético y catabólico de la serina
Resumen biosintético y catabólico de la serina
Enzimas:
- EC 1.1.1.29 Glicerato deshidrogenasa
- EC 1.1.1.81 Hidroxipiruvato reductasa
- EC 1.1.1.95 Fosfoglicerato deshidrogenasa
- EC 1.4.2.1 Glicina deshidrogenasa (citocromo)
- EC 2.1.2.1 Glicina hidroximetiltransferasa
- EC 2.3.1.29 Glicina C-acetiltransferasa
- EC 2.6.1.51 Alanina-glioxilato transaminasa
- EC 2.6.1.52 Fosfoserina transaminasa
- EC 2.7.1.31 Glicerato quinasa
- EC 3.1.3.38 3-Fosfoglicerato fosfatasa
- EC 3.1.3.3 Fosfoserina fosfatasa
- EC 4.3.1.17 L-Serina amonio-liasa
Otras rutas metabólicas que pueden dar serina como producto son:
- Degradación de fosfolípidos que contengan serina.
- En la biosíntesis de la metionina se utiliza una molécula de cisteína como fuente de azufre, para dar la cistationina, la cual se hidroliza para obtenerse serina. El esqueleto precursor de la cisteína es idéntico al de la serina producida.
- Por hidrólisis de proteínas.
Síntesis
La serina racémica puede ser preparada a partir de acrilato de metilo a través de varios pasos.[3] También se produce naturalmente cuando la luz UV incide sobre ciertas mezclas frigoríficas, tales como una combinación de agua, metanol, cianuro de hidrógeno y amoníaco, lo que sugiere que puede ser fácilmente producido en regiones del espacio.[4]
Metabolitos de la serina
La serina es importante en el metabolismo,[2] ya que participa en la biosíntesis de purinas y pirimidinas. Es el precursor de varios aminoácidos como la glicina, la cisteína en plantas y el triptófano en las bacterias. Es también precursor de diversos metabolitos primarios y secundarios, tales como los esfingolípidos, las fosfatidilserinas, la etanolamina y sus derivados, la colina y sus derivados, el ácido fólico, la enterobactina,[5] el ácido 2,3-diaminopropiónico[6] (Constituyente de las capreomicinas), la cicloserina[7] y la monobactama SQ 26,180.[8]
Funciones
La serina juega un importante papel en la función catalítica de muchas enzimas. Se ha demostrado que esto ocurre en los sitios activos de la quimotripsina, la tripsina, y muchas otras enzimas. Se ha demostrado que los gases nerviosos y muchas sustancias utilizadas en los insecticidas actúan mediante la combinación con un residuo de serina en el sitio activo de la acetilcolinesterasa, lo que genera la inhibición total de la enzima. La acetilcolinesterasa degrada el neurotransmisor acetilcolina, que se libera en los cruces del nervio y el músculo con el fin de permitir que el músculo u órgano se relaje. El resultado de la inhibición de la acetilcolina es que la acetilcolina se acumula y sigue actuando de manera que cualquier impulsos nerviosos son transmitidos continuamente y las contracciones musculares no se detienen.[9]
Como componente de las proteínas, su cadena lateral puede sufrir O-glicosilación, en la que puede haber una relación funcional con la diabetes. Es uno de los tres residuos de aminoácidos que son comúnmente fosforilados por las quinasas en la señalización celular en organismos eucariotas.
Referencias
- ↑ Merck Index
- ↑ a b c d Albert L. Lehninger, David Lee Nelson, Michael M. Cox (2005). Principles of biochemistry, Vol. 1 4th ed.. W.H. Freeman,. ISBN 0716743396, 9780716743392.
- ↑ "dl-Serine". Org. Synth.; Coll. Vol. 3: 774. .
- ↑ «Mechanisms of Amino Acid Formation in Interstellar Ice Analogs», Astrophys. J. 660 (1): 911–18, 2007, doi:.
- ↑ Paul M. Dewick (2009). Medicinal natural products: a biosynthetic approach. John Wiley and Sons. ISBN 0470741686, 9780470741689.
- ↑ Mu Wang, Steven J. Gould (1993). «Biosynthesis of capreomycin. 2. Incorporation of L-serine, L-alanine, and L-2,3-diaminopropionic acid». J. Org. Chem. 58 (19): pp. 5176–5180. doi:.
- ↑ Marie-Louise Svensson , Sten Gatenbeck (1982). «The pathway of D-cycloserine biosynthesis in Streptomyces garyphalus». Archives of Microbiology 131 (2): pp. 129-131. doi:.
- ↑ Wells JS, Trejo WH, Principe PA, Bush K, Georgopapadakou N, Bonner DP, Sykes RB. (1982). «SQ 26,180, a novel monobactam. I Taxonomy, fermentation and biological properties.». J Antibiot (Tokyo). 35 (2): pp. 184-188.
- ↑ «d-Serine is an endogenous ligand for the glycine site of the N-methyl-d-aspartate receptor», Proc. Natl. Acad. Sci. USA 97 (9): 4926–31, 2000, doi:, PMID 10781100, PMC 18334, http://www.pnas.org/cgi/pmidlookup?view=long&pmid=10781100.
Categorías:- Aminoácidos glucogénicos
- Aminoácidos neutros polares
Wikimedia foundation. 2010.
