- Potencial de reducción
-
Potencial de reducción
El Potencial de electrodo, Potencial de reducción o Potencial REDOX es como se le conoce a una celda galvánica que produce por la reacción de la celda que no está en equilibrio. El potenciómetro solo permite circular una corriente pequeña, de modo que la concentración de las dos semiceldas permanece invariable. Si sustituimos el potenciómetro por un alambre, pasaría mucha más corriente, y las concentraciones variarían hasta que se alcance el equilibro. En este momento no progresaría más la reacción, y el ptencial "E" se haría cero. Cuando una batería (que es una celda galvánica) se agota (V=0) los productos químicos del interior han llegado al equilibrio, y desde ese momento la bateria ha <<muerto>>.
Contenido
Introducción
La diferencia de potencial que se desarrolla en los electrodos de la celda es una medida de la tendencia de la reacción a llevarse a cabo desde un estado de no equilibrio hasta la condición de equilibrio. El potencial de celda (Ecelda) se relaciona con la energía libre de la reacción,
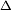 G, mediante:
G, mediante: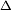 G=-nFEcelda
G=-nFEceldaEjemplo:
2Ag++Cus → 2Ags+Cu2+ Potenciales de semicelda
El potencial de una celda es la diferencia entre dos potenciales de dos semiceldas o de dos electrodos simples, uno relacionado con la semireacción del electrodo de la derecha (Eder) y el otro, con la semirreacción del electrodo de la izquierda (Eizq). Por tanto, de acuerdo con el convenio de signos de la IUPAC, si el potencial de unión líquida es despreciable, o no hay unión líquida, se puede escribir el potencial de la celda, Ecelda, como:
Ecelda = Ederecha - Eizquierda o bien se le conoce como:
Ecelda = Ereducción - Eoxidación Aunque no se pueden determinar los potenciales absolutos de los electrodos como tales, si se puede determinar con facilidad los potenciales de electrodo relativos.
Descarga de una celda galvánica
La celda galvánica está en un estado de no equilibrio debido a que la gran resistencia del voltímetro evita que la celda se descargue de manera significativa. Cuando se mide el potencial de la celda no sucede ninguna reacción y lo que se mide es la tendencia a que suceda la reacción, si se deja que proceda. Si se deja que la celda se descargue al sustituir el voltímetro con un medidor de corriente de baja resistencia, se lleva a cabo la "reacción espontanea de la celda".
Tipos de electrodo
Electrodo de referencia estandar de hidrógeno
Para que los valores de potenciales relativos de electrodo tengan aplicacíon amplia y sean de utilidad, se emplea una semicelda de referencia frente a la cual se comparan todas las demas. Un electrodo como éste debe ser fácil de fabricar, ser reversible y sumamente reproducible. El electrodo estandar de Hidrógeno (EEH), a pesar de que tiene una utilidad práctica limitada, se ha empleado en todo el mundo durante muchos años como electrodo de referencia universal. Es un electrod de gas común.
Definición de potencial de electrodo y potencial estandar de electrodo
Potencial de electrodo
Se define como el potencial de una celda que conste del electrodo en cuestión, como el electrodo de la derecha, y el electrodo estandar de hidrógeno, como el electrodo de la izquierda.
Potencial estandar de electrodo (E°)
Se define como su potencial de elctrodo cuando las actividades de todos los reactivos y los productos sean la unidad.
Tabla de potenciales de electrodo
Ejemplos de algunos potenciales de electrodo
Semirreacción Potencial estandar de elctrodo, V Ag++ e- → Ags +0.799 2H++2e- → H2s 0.000 Cd2++2e- → Cds -0.403 Zn2++2e- → Zns -0.763 Bibliografía
-
-
- Química analítica, Autores Skoog, West, Ed. McGraw-Hill, Septima Edición en español, pps: 416-423
-
-
-
- Analisis químico cuantitativo, Autor Daniel C. Harris, Ed. Reverté, 3ra Edición en español, pag: 428
-
Anexos
Anexo:Tabla de potenciales de reducción
Enlaces externos
Categorías: Electroquímica | Potencial -
Wikimedia foundation. 2010.
