- Proteína de Rieske
-
Proteína de Rieske
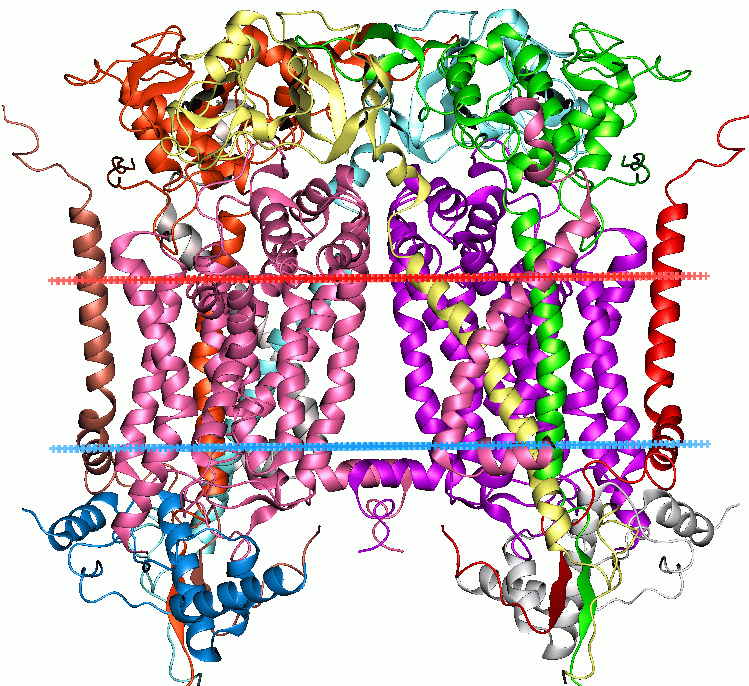 Complejo del citocromo bc1 mitocondrial. (Código PDB 1bcc)
Complejo del citocromo bc1 mitocondrial. (Código PDB 1bcc)
La proteína de Rieske es una proteína hierro-azufre componente del fosforilación oxidativa que cataliza la oxidorreducción de los componentes móviles redox ubiquinol y citocromo c, generando un potencial electroquímico vinculado a la síntesis de ATP.[2] [3]
El complejo consta de tres subunidades en la mayoría de las bacterias, y nueve en mitocondrias: tanto los complejos bacterianos como mitocondriales contienen subunidades de citocromo b y citocromo c1, y una unidad hierro-azufre de "Rieske", que contiene un centro 2Fe-2S de alto potencial.[4] La forma mitocondrial también incluye a otras seis subunidades que no poseen centros redox. La plastoquinona-plastocianina reductasa (complejo b6f), presente en las cianobacterias y los cloroplastos de las plantas cataliza la oxidorreducción de plastoquinol y citocromo f. Este complejo, que es funcionalmente similar a ubiquinol-citocromo c reductasa, comprende citocromo b6, citocromo f y subunidades de Rieske.[5]
La subunidad de Rieske actúa uniéndose a un anión ya sea de ubiquinol o plastoquinol, transfiriendo un electrón al centro 2Fe-2S, luego liberándolo al hierro del grupo hemo del citocromo c o f.[2] [5] La reducción del centro de Rieske aumenta la afinidad de la subunidad en varios órdenes de magnitud, estabilizando el radical de semiquinona en el sitio Q(P).[6] El dominio de Rieske tiene un centro [2Fe-2S]. Dos cisteínas conservadas coordinan un ion de Fe, mientras que el otro ion Fe está coordinado por dos histidinas conservadas. El centro 2Fe-2S está unido a la región C-terminal muy conservada de la subunidad Rieske.
Familia de proteínas de Rieske
Dentro de los homólogos a las proteínas de Rieske se incluyen componentes de proteína hierro-azufre del complejo del citocromo b6f, dioxigenasas hidroxilantes de anillo aromático (ftalato dioxigenasa, benzeno, nafaleno y tolueno 1,2-dioxigenasas) y arsenita oxidasa. La comparación de las secuencias de aminoácidos ha revelado la siguiente secuencia consenso:
- Cys-Xaa-His-(Xaa)15–17-Cys-Xaa-Xaa-His
Estructura tridimensional
Se conocen las estructuras cristalinas de una serie de proteínas Rieske. El plegamiento general, incluye dos subdominios, está dominado por una estructura de β antiparalela y contiene una hélice alfa. Los pequeños subdominios de "centro de unión" son prácticamente idénticos en proteínas de mitocondrias y cloroplastos, mientras que el subdominio mayor es sustancialmente diferente a pesar de una topología de plegamiento común. El subdominio del centro de unión [Fe2S2] tiene un topología de un barril beta antiparalelo incompleto. Un átomo de hierro del centro de Rieske [Fesub>2S2] es coordinado por dos residuos de cisteína y el otro es coordinado por dos a través de los residuos de los átomos Nδ de la histidina. Los ligandos de coordinación del grupo proceden de dos bucles, cada uno aporta una Cys y una His.
Referencias
- ↑ Rieske JS, Maclennan DH, Coleman, R (1964). «Isolation and properties of an iron-protein from the (reduced coenzyme Q)-cytochrome C reductase complex of the respiratory chain» Biochem. Biophys. Res. Commun. Vol. 15. pp. 338–344. DOI 10.1016/0006-291X(64)90171-8.
- ↑ a b Harnisch U, Weiss H, Sebald W (mayo de 1985). «The primary structure of the iron-sulfur subunit of ubiquinol-cytochrome c reductase from Neurospora, determined by cDNA and gene sequencing» Eur. J. Biochem.. Vol. 149. n.º 1. pp. 95–9. DOI 10.1111/j.1432-1033.1985.tb08898.x. PMID 2986972.
- ↑ Gabellini N, Sebald W (febrero de 1986). «Nucleotide sequence and transcription of the fbc operon from Rhodopseudomonas sphaeroides. Evaluation of the deduced amino acid sequences of the FeS protein, cytochrome b and cytochrome c1» Eur. J. Biochem.. Vol. 154. n.º 3. pp. 569–79. DOI 10.1111/j.1432-1033.1986.tb09437.x. PMID 3004982.
- ↑ Kurowski B, Ludwig B (octubre de 1987). «The genes of the Paracoccus denitrificans bc1 complex. Nucleotide sequence and homologies between bacterial and mitochondrial subunits» J. Biol. Chem.. Vol. 262. n.º 28. pp. 13805–11. PMID 2820981.
- ↑ a b Madueño F, Napier JA, Cejudo FJ, Gray JC (octubre de 1992). «Import and processing of the precursor of the Rieske FeS protein of tobacco chloroplasts» Plant Mol. Biol.. Vol. 20. n.º 2. pp. 289–99. DOI 10.1007/BF00014496. PMID 1391772.
- ↑ Link TA (julio de 1997). «The role of the 'Rieske' iron sulfur protein in the hydroquinone oxidation (Q(P)) site of the cytochrome bc1 complex. The 'proton-gated affinity change' mechanism» FEBS Lett.. Vol. 412. n.º 2. pp. 257–64. DOI 10.1016/S0014-5793(97)00772-2. PMID 9256231.
Lecturas complementarias
- Iwata S, Saynovits M, Link TA, Michel H (mayo de 1996). «Structure of a water soluble fragment of the 'Rieske' iron-sulfur protein of the bovine heart mitochondrial cytochrome bc1 complex determined by MAD phasing at 1.5 A resolution» Structure. Vol. 4. n.º 5. pp. 567–79. DOI 10.1016/S0969-2126(96)00062-7. PMID 8736555.
- Huang JT, Struck F, Matzinger DF, Levings CS (diciembre). «Functional analysis in yeast of cDNA coding for the mitochondrial Rieske iron-sulfur protein of higher plants» Proc. Natl. Acad. Sci. U.S.A.. Vol. 88. n.º 23. pp. 10716–20. PMC 53001. DOI 10.1073/pnas.88.23.10716. PMID 1961737.
- Brandt U, Yu L, Yu CA, Trumpower BL (abril). «The mitochondrial targeting presequence of the Rieske iron-sulfur protein is processed in a single step after insertion into the cytochrome bc1 complex in mammals and retained as a subunit in the complex» J. Biol. Chem.. Vol. 268. n.º 12. pp. 8387–90. PMID 8386158.
- Ferraro, D.J., Gakhar, L. and Ramaswamy, S. (2005). «Rieske business: structure-function of Rieske non-heme oxygenases» Biochem. Biophys. Res. Commun.. Vol. 338. pp. 175–190. DOI 10.1016/j.bbrc.2005.08.222. PMID 16168954.
- Mason, J.R. and Cammack, R. (1992). «The electron-transport proteins of hydroxylating bacterial dioxygenases» Annu. Rev. Microbiol.. Vol. 46. pp. 277–305. DOI 10.1146/annurev.mi.46.100192.001425. PMID 1444257.
- Schmidt, C.L. (2004). «Rieske iron-sulfur proteins from extremophilic organisms» J. Bioenerg. Biomembr.. Vol. 36. pp. 107–113. DOI 10.1023/B:JOBB.0000019602.96578.78. PMID 15168614.
- Schneider, D. and Schmidt, C.L. (2005). «Multiple Rieske proteins in prokaryotes: where and why?» Biochim. Biophys. Acta. Vol. 1710. pp. 1–12. PMID 16271700.
Categoría: Proteínas
Wikimedia foundation. 2010.

