- Citocromo c
-
Citocromo C, somático 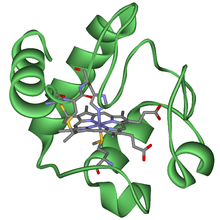
HUGO 19986 Símbolo CYCS Símbolos alt. HCS Datos genéticos Locus Cr. 7 p21 Bases de datos Entrez 54205 OMIM 123970 RefSeq NM_018947 UniProt P99999 El citocromo c es una proteína pequeña, que funciona como transportador electrónico mitocondrial entre los complejos respiratorios III y IV. Se trata de una proteína monomérica, es decir con un solo polipéptido; unido a esta estructura hay un grupo prostético constituido por un hemo C, es decir, una protoporfirina IX con un ion de hierro coordinado.
El grupo prostético porfirínico está unido a la proteína covalentemente, a través de dos cisteínas. El grupo prostético aparece inmerso en el interior de la estructura, en un entorno hidrofóbico.
Contenido
Localización
Se encuentra situado en las mitocondrias de la mayoria de células eucariotas, en la membrana mitocondrial interna.
Síntesis
Está codificado por el ADN nuclear y se sintetiza como un precursor que posee una presecuencia N-terminal de 61 aminoácidos. Parte de esta presecuencia es separada por una proteasa de la matriz, cuando el polipéptido se inserta en la membrana interna; así, queda anclado con la orientación adecuada.
Función
En la cadena respiratoria
El "complejo III" o Complejo citocromo bc1; obtiene dos electrones desde QH2 y se los transfiere a dos moléculas de citocromo c, que es un transportador de electrones hidrosoluble que se encuentra en el espacio intermembrana de la mitocondria. Al mismo tiempo, transloca dos protones a través de la membrana por los dos electrones transportados desde el ubiquinol.
El complejo IV o Citocromo c oxidasa; capta cuatro electrones de la cuatro moléculas de citocromo c y se transfieren al oxígeno (O2), para producir dos moléculas de agua (H2O). Al mismo tiempo se translocan cuatro protones al espacio intermembrana, por los cuatro electrones. Además "desaparecen" de la matriz 4 protones que forman parte del H2O.
En la apoptosis
Otra vía de inducción de apoptosis es la vía llamada mitocondrial. Las proteínas de la familia de Bcl-2 regulan la apoptosis ejerciendo su acción sobre la mitocondria. La activación de proteínas pro-apoptóticas de la familia de Bcl-2 produce un poro en la membrana externa de las mitocondrias que permite la liberación de numerosas proteínas del espacio intermembrana; entre ellas, el citocromo c.
El citocromo c, una vez en el citosol, activa un complejo proteico llamado "apoptosoma", que activa directamente a la caspasa-9. Una vez que la caspasa-9 está activada, ésta activa a las caspasas efectoras como la caspasa-3, lo que desencadena las últimas fases de la apoptosis.
Las proteínas de la familia de Bcl-2 se agrupan en tres familias: la familia de las proteínas antiapoptóticas (Bcl-2, Bcl-Xl, Mcl-1 y otras); la familia de proteínas proapoptóticas de tipo "multidominio" (Bax y Bak) y las proteínas proapoptóticas de tipo "BH3-only" (Bid, Bim, Bad y otras). Las proteínas tipo multidominio pueden producir poros por si solas en liposomas, lo que indica que probablemente son suficientes para formar el poro mitocondrial que permite la liberación del citocromo c.
Como prueba de evolución
La comparación de la estructura primaria de una misma proteína en especies diversas tiene un enorme interés desde los puntos de vista funcional y filogenético. Cuanto más alejadas estén las especies analizadas en el árbol filogenético, más diferencias se podrán observar en la estructura primaria de proteínas análogas.
El citocromo c de humanos y chimpancés está formado por 104 aminoácidos, exactamente los mismos y en el mismo orden. El citocromo del mono Rhesus sólo difiere del de los humanos en un aminoácido de los 104; el del caballo en 11 aminoácidos; y el del atún en 21. El grado de similitud refleja la proximidad del ancestro común, lo cual permite reconstruir la filogenia de estos organismos.
Estudios recientes
La modificación del citocromo C impide que induzca la muerte celular y podría proteger del estrés oxidativo
El proceso de nitración permite que el citocromo C (cyt c) se libere de la mitocondria sin inducir la apoptosis, según los resultados de un estudio de varios centros de Estados Unidos que se publica hoy en la edición electrónica Proceedings of the National Academy of Sciences y en el que ha participado el grupo de Cristina Muñoz-Pinedo, del Instituto de Investigación Biomédica de Bellvitge (Idibell), en Barcelona.
Bibliografía
Categorías:- Genes del cromosoma 7
- Hemoproteínas
Wikimedia foundation. 2010.