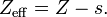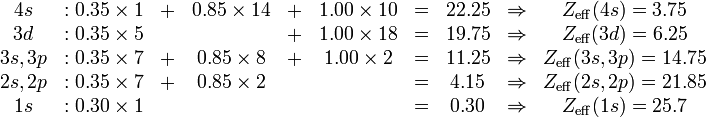- Reglas de Slater
-
Reglas de Slater
En química cuántica, 'las reglas de Slater' proporcionan valores numéricos para el concepto de carga nuclear efectiva. En cualquier átomo, cada electrón experimenta una carga nuclear menor, debido al efecto pantalla de los otros electrones. Y para cada electrón, las reglas de Slater proporcionan un valor para la constante de apantallamiento, conocida como s, S, o σ, que relaciona las cargas nucleares efectiva y real, según:
Estas reglas semiempíricas fueron inventadas por John C. Slater y publicadas en 1930[1]
Reglas
Primero,[1] [2] los electrones son ordenados en una secuencia de grupos que mantiene juntos los orbitales s- y p- con el mismo número cuántico principal, y sigue con el orden orbital de la tabla periódica (ignorando las irregularidades):
-
- [1s] [2s,2p] [3s,3p] [3d] [4s,4p] [4d] [4f] [5s, 5p] [5d] etc.
Cada grupo tiene una constante de apantallamiento diferente, que depende del número y del tipo de electrones de los grupos que le preceden.
La constante de apantallamiento para cada grupo es la suma de las siguientes contribuciones:
- Una cantidad de 0.35 por cada otro electrón del mismo grupo, excepto para el grupo [1s], donde el otro electrón contribuye sólo con 0.30.
- Si el grupo es del tipo [s p], una cantidad de 0.85 por cada electrón con número cuántico principal una unidad menor, y una cantidad 1.00 por cada electrón con un número cuántico principal aún menor.
- Si el grupo es del tipo [d] o [f], suma una cantidad 1.00 por cada electrón con un número cuántico principal igual o menor.
En forma de tabla, las reglas se resumen en:
Grupo Otros electrones del mismo grupo Electrones del nivel n-1 Electrones de niveles < n-1 [1s] 0.30 N/A N/A [ns,np] 0.35 0.85 1.00 [nd] or [nf] 0.35 1.00 1.00 Ejemplo
Un ejemplo, proporcionado por el artículo original de Slater, es para el átomo de hierro, que tiene una carga nuclear 26 (Z=26) y una configuración electrónica:
- 1s22s22p63s23p63d64s2
La constante de apantallamiento, y en consecuencia la carga nuclear efectiva, para cada electrón se deduce de:[1]
Referencias
Categorías: Física atómica | Enlace químico | Química cuántica
Wikimedia foundation. 2010.