- Sulfato de cobre (I)
-
Sulfato de cobre (I)
Cu+ 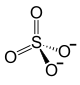 Cu+
Cu+Nombre (IUPAC) sistemático Tetraoxosulfato (VI) de cobre (I) General Otros nombres Sulfato de cobre (I)
Sulfato cuproso
Sulfato de dicobreFórmula semidesarrollada Cu2SO4 Fórmula molecular n/d Identificadores Número CAS 17599-81-4
31207-09-7[1]Propiedades físicas Estado de agregación sólido Apariencia incoloro Masa molar 223,1546 g/mol Punto de ebullición 603 K (330 °C) Propiedades químicas Compuestos relacionados Otros iones óxido de cobre(I)
cloruro de cobre(I)
bromuro de cobre(I)
cianuro de cobre(I)Otros cationes sulfato de cobre (II)
sulfato de plata
sulfato de zinc
sulfato de níquel(II)Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl sulfato de cobre (I), sulfato cuproso o sulfato de dicobre es una sal insoluble de color blanco, formada por el anión sulfato y el catión cobre en estado de oxidación +1, de fórmula Cu2SO4. Este estado de oxidación es poco estable, por tanto el sulfato de cobre (I) es mucho menos frecuente que su análogo el sulfato de cobre (II) CuSO4.
Contenido
Obtención y propiedades
Los principales países productores son: México, Brasil, Chile, Rusia, Taiwan, Italia, China y Argentina.[cita requerida]
En Chile los Principales Productores son: Minera Capacho Viejo (II Region), Minera San Geronimo (IV Region), VaporProcesos (RM) y Compañía Minera Josefina S.A. (IV Region).
Suele obtenerse a partir de soluciones de sulfato de cobre(II), por la acción de un reductor como tiosulfato sódico diluido.
En laboratorio puede obtenerse mezclando disoluciones de sulfato de cobre (II), sulfito ácido de sodio e hidróxido de sodio.
2CuSO4 + NaHSO3 + NaOH → Cu2SO4 + H2SO4 + Na2SO4
Su falta de color, en contraste con otras sales de metales de transición que son coloreadas, incluídas las sales de Cu(II), se explica por su configuración electrónica. Al tener la capa d totalmente ocupada, no son posibles transiciones
 que típicamente tienen una energía en el rango de la luz visible.
que típicamente tienen una energía en el rango de la luz visible.Reacciones químicas
Sus disoluciones acuosas no son completamente estables y lentamente dismutan o disproporcionan según la reacción:
Igual que otros compuestos de Cu(I) se oxida con bastante facilidad a Cu(II), frente a numerosas sustancias, inclusive el oxígeno atmosférico. Para evitar estas oxidaciones, sus disoluciones deben incluir un protector. Precisamente por su facilidad para oxidarse, puede usarse como reductor frente a sustancias orgánicas, en reacciones de síntesis.[2]
Por otro lado, cataliza un conjunto muy variado de reacciones en disolventes orgánicos y en solución acuosa, como la preparación del alcohol etílico sintético. Muchas de estas reacciones y en particular las últimas, implican sistemas de oxidación‑reducción y un ciclo redox Cu(I)‑Cu(II).
También forma algunos complejos como sulfato de tris(etilentiourea)cobre(I) , [Cu(etu)3]SO4, o sulfato de tris(acetonitril)cobre(I)
Históricamente, se ha usado como sustitutivo de sulfato ferroso en algunas recetas para preparar tinta ferrogálica.[3]
Usos y Aplicaciones
El sulfato de cobre es especialmente elaborado para suplir funciones principales del Cobre en la planta, en el campo de las enzimas: Oxidazas del ácido ascórbico, polifenol, citocromo, etc. También forma parte de la plastocianina contenida en los cloroplastos y que participa en la cadena de transferencia de electrones de la fotosíntesis. Su absorción se realiza mediante un proceso activo metabólicamente. Prácticamente, no es afectado por la competencia de otros cationes. Por el contrario, afecta a los demás cationes. Este producto puede ser aplicado a todo tipo de cultivo y en cualquier zona climática en condiciones naturales de invernaderos; bajo las recomendaciones de un Ingeniero Agrónomo.
Tambien se usa como Como bacteriostático en el agua de piscinas, para mantenerlas limpias y transparentes, y como suave oxidante y colorante en superficies metálicas que deben ser mecanizada y, para trazar las líneas de referencia de los trabajos.
Referencias
Categorías:- Sulfatos
- Compuestos de cobre
Wikimedia foundation. 2010.

