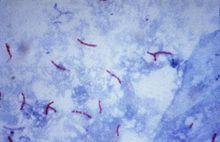
- Tinción de Ziehl Neelsen
-
La tinción de Ziehl-Neelsen (BAAR) es una técnica de tinción diferencial rápida y económica, para la identificación de microorganismos patógenos, por ejemplo M. tuberculosis.
Fue descrita por primera vez por dos médicos alemanes, Franz Ziehl, un bacteriólogo y Friedrich Neelsen, un patólogo.
Contenido
Fundamento
Las paredes celulares de ciertos parásitos y bacterias contienen ácidos grasos (ácidos micólicos) de cadena larga (50 a 90 átomos de carbono) que les confieren la propiedad de resistir la decoloracíón con alcohol-ácido, después de la tinción con colorantes básicos. Por esto se denominan ácido-alcohol resistentes. Las micobacterias como M. tuberculosis y M. marinum y los parásitos coccídeos como Cryptosporidium se caracterizan por sus propiedades de ácido-alcohol resistencia. La coloración clásica de Ziehl-Neelsen requiere calentamiento para que el colorante atraviese la pared bacteriana que contiene ceras. Al suspender el calentamiento y enfriar con agua, provoca una nueva solidificación de lo ácidos grasos de modo que el colorante ya no puede salir de las bacterias. Por otro lado, el calentamiento aumenta la energía cinética de las moléculas del colorante lo cual también facilita su entrada a las bacterias. Las bacterias que resisten la decoloración son de color rojo y la que no se ven de color azul, ya que se utiliza azul de metileno como tinción de contraste.
Técnica
Esta técnica puede realizarse tanto en muestras histológicas como citológicas.
Variante histológica
Para demostrar la presencia de BAAR en cortes de tejido en parafina.Los reactivos necesarios para su realización son los siguientes:
- ácido periódico 58%
- carbol fucsina de Ziehl (fucsina fenicada). Preparar mezclando en el orden dado:
- 0,5 g fucsina básica
- 50 cc agua destilada
- 5 cc etanol absoluto
-
- 28,5 g cristales de fenol derretidos
- hematoxilina
- alcohol ácido 1%:
- alcohol de 35º
- ácido clorhídrico
El procedimiento es el siguiente:
- desparafinar e hidratar los cortes
- ácido periódico 5%, 10 min
- lavar con agua destilada
- fucsina fenicada, 15 min
- decolorar en alcohol ácido al 50%
- lavar con agua destilada
- hematoxilina, 10 min
- azulidificar con, por ejemplo, carbonato de litio
- deshidratar, aclarar y montar preparaciones
Resultados
- BAAR: rojo.
- Núcleos: azul semiamarillo.
Variante clásica o "en caliente"
Ésta y la siguiente variantes son para preparaciones citológicas.
- Hacer un frotis de la muestra.
- La fijación al calor asegurará de que el frotis quede adherido al portaobjetos. Un frotis muy delgado puede darle resultados falsamente negativos y un frotis muy grueso puede desprenderse del portaobjetos durante la tinción.
- Utilizando pinzas, coloque los portaobjetos en una gradilla de tinción con los extendidos hacia arriba. Nunca tiña más de 12 portaobjetos a la vez.
- Dejar el frotis sobre el puente de tinción.
- Aplicar fucsina-fenicada.
- Deje que el colorante permanezca sobre los portaobjetos durante 5 minutos. Mantenga el calor durante este período.
- Calentar con un mechero hasta la emisión de vapores (3-5 minutos).
- Se requiere el tiempo adecuado para que la fucsina fenicada penetre y tiña la pared celular de la bacteria. No deje que hierva o se seque el colorante.
- Lave suavemente el colorante de cada portaobjetos con agua corriente fría hasta que toda la tinción libre quede lavada. Lave suavemente de manera que el extendido no se barra del portaobjetos. Retire el exceso de agua.
- Decolorar con alcohol-ácido.
- Cubra cada portaobjetos con la solución decolorante, tal como alcohol ácido y manténgalo sobre el portaobjetos durante 7 minutos. Si no se decolora suficientemente, el contenido del esputo que no son bacilos TBC puede permanecer teñido. Enjuague con agua una vez más los portaobjetos y quite el exceso de agua. Si los portaobjetos aún están rosa, aplique una cantidad adicional de la solución decolorante de 1 a 3 minutos.
- Aplicar azul de metileno (1 minuto).
- Aplique la solución de contraste, azul de metileno, durante 1 minuto.
- Enjuagar con agua
- Vuelva a enjuagar con un leve chorro de agua e incline cada portaobjetos hasta drenar el exceso de agua. Finalmente, coloque cada portaobjetos en una gradilla a que sequen al aire.
- Ahora coloquele una pequeñita gota de aceite de inmersión y haga la observación al microscopio con 100 x 100
o en "frío"
- Hacer un frotis.
- Dejarlo en el puente de tinción.
- Aplicar fucsina-fenicada (solución con fenol y mayor concentración de fucsina).
- Dejar en vasos coplin durante 20 minutos.
- Decolorar con alcohol acido.
- Lavar con agua del grifo.
- Contrastar con azul de metileno
Algunos microorganismos ácido-alcohol resistentes
- Mycobacterium: fuertemente ácido-alcohol resistentes.[1]
- Nocardia y Actinomices: débilmente ácido-alcohol resistentes.[2]
- Parásitos coccídeos (Cryptosporidium) de muestras [fecales].[3]
CARMAN 3-F 25-11-09
Otros tipos de tinción
- Tinción de Gram
- tinción ácido - alcohol resistente
- tinción de esporas
- tinción negativa
Referencias
- ↑ SEBHATU, Mineab, KIFLOM, Bahlbi, SEYOUM, Melles et al. Determining the burden of tuberculosis in Eritrea: a new approach. Bull World Health Organ [online]. 2007, vol. 85, no. 8 [citado 8 de noviembre 2007], pp. 593-599. Disponible: [1]. [ISSN] 0042-9686.
- ↑ LANIADO-LABORIN, Rafael and CABRALES-VARGAS, Noemí. A positive sputum smear test is not always indicative of pulmonary TB: Another reason to order routine cultures. Rev. Inst. Nal. Enf. Resp. Mex. [online]. 2005, vol. 18, no. 4 [citado 8 de noviembre 2007], pp. 286-289. Disponible: [2]. ISSN 0187-7585.
- ↑ ROSILÉIA M. DE QUADROS. Detection of Cryptosporidium oocysts by auramine and Ziehl Neelsen staining methods. Parasitol Latinoam 61: 117 - 120, 2006. [3]
- Baciloscopía directa de BAAR Association of Public Health Laboratories / Centers for Disease Control and Prevention.
Bibliografía
- Sheehan, Dezna; Hrapchak, Barbara. Theory and practice of Histotechnology (2 Ed. edición). The C.V. Mosby Company.
- ARP, ed. Métodos Histotecnológicos. Instituto de patología de las Fuerzas Armadas de los EEUU (AFIP).
Wikimedia foundation. 2010.