- Geometría molecular piramidal cuadrada
-
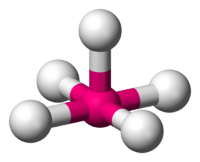 Estructura idealizada de un compuesto de coordinación con una geometría molecular piramidal cuadrada
Estructura idealizada de un compuesto de coordinación con una geometría molecular piramidal cuadrada
En química, la geometría molecular piramidal cuadrada describe la forma o geometría molecular de ciertos compuestos de fórmula química ML5, donde M es un átomo central y L es un ligando. Si los átomos del ligando estuviesen conectados, la forma resultante sería la de una pirámide de base cuadrada.
Contenido
Características
Esta geometría es común en ciertos compuestos en los que el átomo central es un elemento representativo que tiene un par solitario estereoquímicamente activo, tal como se describe en teoría RPECV. Ciertos compuestos cristalizan tanto con geometría de bipirámide trigonal como formando estructuras piramidales cuadradas, en particular, [Ni(CN)5]3&minus.[1]
Como estado de transición en la pseudorotación de Berry
Cuando una molécula bipiramidal trigonal sufre una pseudorotación de Berry, pasa a través de una etapa intermedia con geometría cuadrada plana. Así, a pesar de que esa geometría se ve rara vez en moléculas en estado fundamental, podemos encontrarla como resultado de una distorsión de baja energía a partir de una bipirámide trigonal.
La pseudorotación también se da en moléculas piramidales cuadradas. Las moléculas con esta geometría, a diferencia de la bipiramidal trigonal, presentan una vibración más fuerte. El mecanismo utilizado es similar al mecanismo de Berry.
Ejemplos
Algunos compuestos moleculares que adoptan la geometría piramidal cuadrada son XeOF4,[2] y XF5 (X = Cl, Br, I).[3] [4] Los complejos de vanadio (IV), como por ejemplo [VO(acac)2] son piramidales cuadrados (acac=acetilacetonato, un anion derivado de la 2,4-pentanodiona que ha perdido un protón).
Véase también
- Método AXE
- Pirámide cuadrada
- Molécula hipervalente
- Geometría molecular
Enlaces externos
- Chem Química, estructuras, y moléculas en 3D
- Centro de estructura molecular de la Universidad de Indiana
- Simetrías de grupo puntual. Ejemplos interactivos.
- Modelado molecular
- Visualización de estructura plana trigonal animada
Referencias
- ↑ «Structure of Ni(CN)53−. Raman, infrared, and x-ray crystallographic evidence». Inorg. Chem. 9: pp. 2415. 1970. doi:.
- ↑ "Square Pyramidal Molecular Geometry". VSEPR. http://www.up.ac.za/academic/chem/mol_geom/planpyr.htm
- ↑ "Square Pyramidal Geometry". http://intro.chem.okstate.edu/1314F97/Chapter9/5BP1LP.html
- ↑ G. L. Miessler and D. A. Tarr “Inorganic Chemistry” 3rd Ed, Pearson/Prentice Hall publisher, ISBN 0-13-035471-6.
Wikimedia foundation. 2010.
