- TREPEV
-
La Teoría de Repulsión de Pares de Electrones de Valencia (TRePEV o teoría RPECV)[1] es un modelo en química para predecir la forma de cada una de las moléculas basado en el grado de repulsión electrostática de los pares de electrones.[2] También es llamada teoría Gillespie-Nyholm después de sus dos principales desarrolladores.[3]
La premisa de TRePEV es que los pares de electrones de valencia alrededor de un átomo se repelen mutuamente, y por lo tanto, adoptan un acuerdo que minimiza esta repulsión, determinando la geometría molecular. El número de pares de electrones alrededor de un átomo, tanto enlazantes como no enlazantes, se llama su número estérico.
La teoría TRePEV es generalmente comparada y contrastada con la teoría del enlace de valencia, que se ocupa de la forma molecular a través de orbitales que son energéticamente accesibles para la vinculación. La teoría del enlace de valencia se ocupa de la formación de enlaces sigma y pi. La teoría de orbitales moleculares es otro modelo para la comprensión de cómo los átomos y los electrones se ensamblan en moléculas e iones poliatómicos.
La teoría TRePEV ha sido criticado por no ser cuantitativa, y por lo tanto limita a la generación de "en bruto", a pesar de que estructuralmente precisa, geometrías moleculares de las moléculas covalentes. Sin embargo, campos de fuerza de mecánica molecular basados en TRePEV también se han desarrollado.[4]
Contenido
Historia
La idea de establecer una correlación molecular entre la geometría de una molécula y el número de electrones de valencia se presentó por primera vez en 1940 por Nevil Sidgwick y Herbert Powell en la Universidad de Oxford.[5] En 1957 Ronald Gillespie y Ronald Sydney Nyholm del University College London refinaron el concepto construyendo una teoría detallada que permitía elegir, entre varias alternativas geométricas, la más adecuada para una molécula determinada.[6] [7]
Descripción
La TRePEV (Teoría de Repulsión de Pares de Electrones de Valencia) está basada en la idea de que la geometría de una molécula, o ion poliatómico, del tipo ABn, donde A es el átomo central y B los átomos periféricos, o ligandos, está condicionada, principalmente, por la repulsión, de tipo culombiana, entre los pares de electrones de la capa de valencia alrededor del átomo central.[8]
La geometría es aquella que proporciona a los pares de electrones de la capa de valencia la energía mínima. En realidad, da la casualidad que cuando una distribución de electrones es la adecuada, coincide con una repulsión interelectrónica mínima.
Los pares de electrones pueden ser de dos tipos dependiendo de si forman parte, o no, de un enlace, clasificándose en pares de enlace y pares sueltos, (también denominados pares libres, o pares no enlazantes).
Existen tres tipos de interacciones repulsivas entre los pares de electrones de una molécula cada una con un determinado valor de intensidad. Ordenadas de mayor repulsión a menor repulsión las interacciones posibles son:
- La repulsión par no enlazante - par no enlazante (PNE-PNE).
- La repulsión par no enlazante - par enlazante (PNE-PE).
- La repulsión par enlazante - par enlazante (PE-PE).
Teniendo en cuenta esta división en dos clases de pares cualquier molécula, de este tipo, se puede expresar como ABnEm. Donde n es el número de pares enlazantes y E el de pares de no enlace.
Una molécula con un atómo central que cumpla la regla del octeto tendrá cuatro pares de electrones en su capa de valencia. Si los cuatro pares son enlazantes los átomos enlazados se dispondrán en los vértices de un tetraedro regular. El ángulo de enlace tetraédrico es 109,5°.
Como se ha comentado la repulsión par no enlazante - par no enlazante (PNE-PNE) se considera más fuerte que la repulsión par no enlazante - par enlazante (PNE-PE), la cual es a su vez más fuerte que la repulsión par enlazante - par enlazante (PE-PE). Entonces, el ángulo que formen dos pares enlazantes será más pequeño que el formado por los pares (PNE-PE) y éste a su vez más pequeño que el formado por los pares (PNE-PNE).
En este sentido concuerda bastante bien con los datos experimentales. La explicación para justificar una mayor intensidad en la interacción PNE-PNE, y por tanto un ángulo de apertura mayor que en las demás interacciones, se basa en la mayor dispersión de la nube electrónica de los electrones alojados en los orbitales que no enlazan.
Reglas adicionales para la predicción de la geometría molecular
- Las repulsiones ejercidas por los pares de enlace disminuyen al aumentar la electronegatividad de los átomos periféricos. Por ejempo, si se comparan el NH3 con el NF3, moléculas con el átomo central pertenecientes al mismo grupo, y misma geometría, (piramidal), los ángulos de enlace son, respectivamente : 106.6 º y 102.2 º. Téngase en cuenta que el F presenta una electronegatividad de 3,98, en la escala de Pauling, y el H de sólo 2,20.
- La formación de enlaces múltiples, (dobles) no afecta a la estereometría de la molécula, la cual está determinada fundamentalmente por los enlaces σ y los pares de electrones libres.
- La repulsión entre pares de electrones no enlazantes de átomos con capas llenas es mayor que la repulsión entre pares de electrones pertenecientes a átomos con capas de valencia incompleta. Como se puede observar en la progresiva disminución de los ángulos de la secuencia de moléculas H2S, H2Se, H2Te, H2O .
- Cuando el átomo central presenta la capa de valencia incompleta, y uno o más orbitales libres vacíos, existe una tendencia a que los pares de electrones libres de los átomos periféricos se transfieran al primero, como ocurre en el BF3. Los pares de electrones libres que rodean a los átomos de fluor pueden cederse al orbital pz vacío del B.
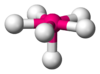
- Cuando hay 5 ó 7 pares de electrones las posiciones no son completamente equivalentes. Por ejemplo, en una molécula con geometría de bipirámide trigonal (5 pares), como es el caso del PF5 se pueden distinguir posiciones axiales y posiciones ecuatoriales.
TRePEV frente a otras teorías
La TRePEV se compara y se contrasta con la teoría del enlace de la capa de valencia, la cual determina la forma la geometría molecular a través de los orbitales que son energéticamente accesibles para enlazar. La Teoría Orbital Molecular se concentra más en la formación de enlaces Sigma y Pi. La Teoría Orbital Molecular es un modelo más sofisticado para entender cómo átomos y electrones se ensamblan en moléculas e iones poliatómicos.
El Método Axe es comúnmente usado para encontrar la geometría de las moléculas siguiendo la teoría TRePEV.[9]
Ejemplos
El metano (CH4) es tetraédrico porque hay cuatro pares de electrones. Los cuatro átomos de hidrógeno están posicionados en los vértices de un tetraedro, y el ángulo de unión es de 109.5°. Esto es una molécula del tipo AB4. A el átomo central y B representa a los otros átomos.
El amoníaco (NH3) tiene tres pares de electrones involucrados en la unión, pero hay un par suelto de electrones en el átomo de nitrógeno. No está unido a ningún otro átomo; aun así, influencia a la geometría a través de repulsiones. Como en el metano, hay cuatro regiones de densidad de electrones. Por lo tanto, la orientación general de las regiones de densidad electrónica es tetraédrica. Por otra parte, solo hay tres átomos externos. Esto es una molécula del tipo AB3E porque el par de electrones suelto es representado por una E. La forma general de la molécula es una pirámide trigonal porque el par suelto no es "visible". La geometría de una molécula se obtiene a partir de la relación de los átomos aún a pesar de que puede ser influenciada por los pares de electrones sueltos.
Tipo de molécula Forma Disposición electrónica† Geometría‡ Ejemplos AB1En Molécula diatómica 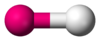
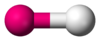
HF, O2 AB2E0 Lineal 
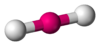
Angular 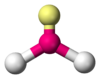
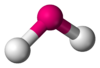
NO2−, Angular 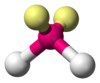
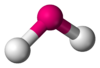
H2O, OF2 AB2E3 Lineal 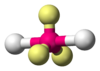

Triangular plana 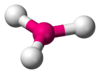
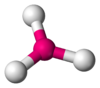
Pirámide trigonal 
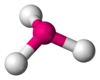
Forma de T 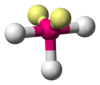
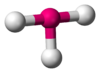
Tetraédrica 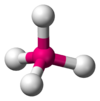
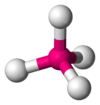
CH4, Balancín 
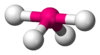
Cuadrada plana 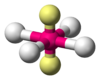
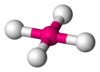
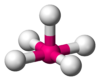
Bipirámide trigonal 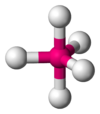

PCl5 AB5E1 Pirámide cuadrada 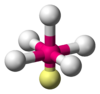
Octaédrica 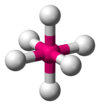
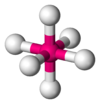
SF6 AB6E1 Pirámide pentagonal 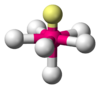
XeOF—5, IOF2-5[10] AB7E0 Bipirámide pentagonal 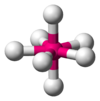
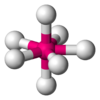
editar] Excepciones Hay grupos de compuestos donde fallan las predicciones de la TRePEV
Compuestos de metales de transición
No se pueden describir correctamente muchas estructuras de compuestos de metales de transición lo que se puede atribuir a la interacción de los electrones d del core interno con los ligandos, que se encuentran más allá de la esfera de coordinación de los pares solitarios.
Referencias
- ↑ Es frecuente el empleo del acrónimo inglés VSEPR, debido a su gran difusión dentro de organismos internacionales como la IUPAC. Véase, por ejemplo, VSEPR en textoscientificos.com.
- ↑ Modern Inorganic Chemistry W.L. Jolly ISBN 0-07-032760-2
- ↑ H. Stephen Stoker (2009). General, Organic, and Biological Chemistry. Cengage Learning. p. 119. ISBN 0547152817, 9780547152813.
- ↑ VGS Box. Journal of Molecular Modeling, 1997, 3, 124-141.
- ↑ http://www.jstor.org/pss/97507 N.V.Sidgwick and H.M.Powell, Proc.Roy.Soc.A 176, 153-180 (1940) Bakerian Lecture. Stereochemical Types and Valency Groups
- ↑ R.J.Gillespie and R.S.Nyholm, Quart.Rev. 11, 339 (1957)
- ↑ R.J.Gillespie, J.Chem.Educ. 47, 18(1970)
- ↑ Modern Inorganic Chemistry W.L. Jolly ISBN 0-07-032760-2
- ↑ Chemistry Quick Study Guide. Mobile Reference, 2007. ISBN: 160501107X. Pág. 242
- ↑ Por favor, pon la referencia que aparece aquí.
Enlaces externos
- http://www.acienciasgalilei.com/alum/qui/EQtema07.pdf
- http://treefrog.fullerton.edu/chem/at.html#model
Wikimedia foundation. 2010.
Mira otros diccionarios:
TREPEV — La Teoría de Repulsión de Pares Electrónicos de Valencia o TRePEV es un modelo en química que apunta a representar las Forma molecular de molecules individuales. Para lograr esto, es necesario construir una estructura de Lewis que muestre todas… … Enciclopedia Universal
Geometría molecular de balancín — Modelo de bolas de una molécula con forma de balancín. En Química, la geometría molecular de balancín (trad. del inglés, Seesaw molecular geometry) describe la disposición de cuatro átomos en torno a un átomo central con un par de electrones no… … Wikipedia Español
Ácido — Para otros usos de este término, véase Sabor ácido y LSD. Un ácido (del latín acidus, que significa agrio) es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una… … Wikipedia Español
Óxido de azufre (VI) — Nombre (IUPAC) Óxido de azufre (VI … Wikipedia Español
Cloruro de fósforo (V) — Pentacloruro de fósforo … Wikipedia Español
Enlace químico — Un enlace químico es el proceso físico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área… … Wikipedia Español
Enlace por puente de hidrógeno — Saltar a navegación, búsqueda Ejemplo de enlace de hidrógeno intermolecular en un complejo dimérico autoensamblado molecular reportado por Meijer y colaboradores … Wikipedia Español
Geometría molecular — Geometría de la molécula de agua. La geometría molecular o estructura molecular se refiere a la disposición tri dimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad … Wikipedia Español
Momento dipolar químico — Para otros usos de este término, véase momento dipolar. Se define como momento dipolar químico (μ) a la medida de la intensidad de la fuerza de atracción entre dos átomos, es la expresión de la asimetría de la carga eléctrica. Está definido como… … Wikipedia Español
Geometría molecular bipiramidal trigonal — ax = axial eq = ecuatorial En Química, la geometría molecular bipiramidal trigonal describe la disposición de seis átomos, cinco de los cuales se ubican en torno a el átomo restante, formando una bipirámide triangular. Se trata de uno de los poco … Wikipedia Español
