- Síntesis de indoles de Bartoli
-
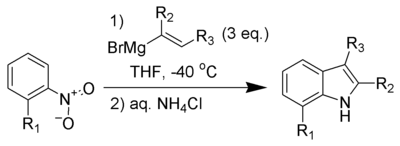
La Síntesis de Indoles de Bartoli es un método de síntesis orgánica que consiste en la reacción de nitroarenos orto-sustituidos con reactivos vinílicos de Grignard para formar indoles sustituidos.
La reacción no se lleva a cabo sin la sustitución orto en el grupo nitro. Tres equivalentes del reactivo vinílico de Grignard también son necesarios para obtener buenos rendimientos. Éste método se ha convertido en uno de los mecanismos más cortos y flexibles para obtener indoles hepta-sustituidos. La síntesis de indoles por el método de Leimgruber-Batcho da una flexibilidad similar para los derivados de indol. Una ventaja de la síntesis de indoles por el método de Bartoli, es la capacidad para producir indoles sustituidos en ambos lados de anillo carbocíclico y en el anillo de pirrol, lo que es difícil de lograr mediante la síntesis de Leimgruber-Batcho.[1]
Contenido
Mecanismo de Reacción
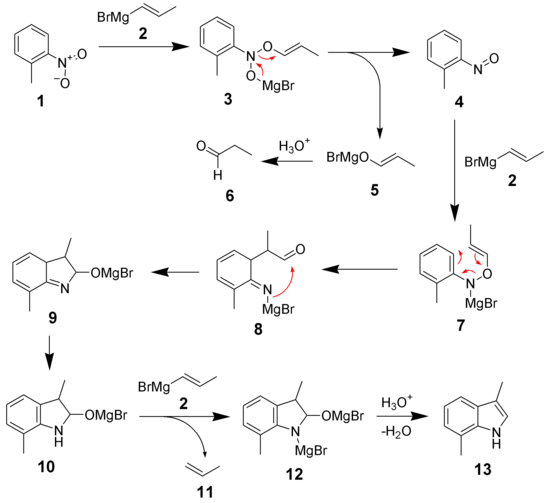
El mecanismo de síntesis de indoles por el método de Bartoli se ilustra a continuación, usando o-nitrotolueno (1) y el reactivo de Grignard propenílico (2) para formar 3,7-dimetilindol (13).
El mecanismo comienza con la adición del reactivo de Grignard (2) al nitroareno (1) para formar un intermediario 3. El intermediario 3 se descompone espontáneamenmte para formar un nitrosoareno (4) y una sal de magnesio (5). La sal de magnesio libera un compuesto carbonílico (6). La reacción del nitrosoareno (4) con un segundo equivalente del reactivo de Grignard (2) forma un intermediario (7). El impedimento estérico del grupo orto provoca un rearreglo [3,3]-sigmatrópico formando el intermediario 8. La ciclación y tautomerización dan un intermediario 10, el cual reaccionará con un tercer equivalente del reactivo de Grignard (2) para dar una sal dimagnésica de indol (12). En un paso final de la reacción se elimina agua y da como producto el indol deseado (13).
Por lo tanto, tres equivalentes del reactivo de Grignard son necesarios, ya que un equivalente se convierte en un compuesto carbonílico (6), otro equivalente se protona formando un alqueno (11), y el tercer equivalente se incorpora al anillo del indol. El intermediario nitroso (4) ha sido aislado de la reacción. Adicionalmente, la reacción del intermediario nitroso (4) con dos equivalentes del reactivo de Grignard produce el correspondiente indol.
Modificación de Dobbs
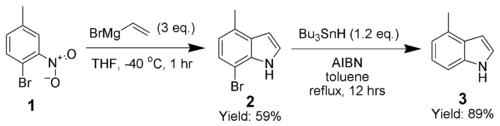
Adrian Dobbs realizó modificaciones de la síntesis de Bartoli con el fin de incrementar los rendimientos. Se utiliza un orto-bromuro como grupo orientador, el cual es removido posteriormente con AIBN e hidruro de tributilestaño.[2]
Referencias
- ↑ Jie Jack Li (2009). Name Reactions. A Collection of Detailed Reaction Mechanisms 4th Edition. Berlín, De: Springer. ISBN 978-3-642-01052-1.
- ↑ Dobbs, A (2001). «Total Synthesis of Indoles from Tricholoma Species via Bartoli/Heteroaryl Radical Methodologies». J. Org. Chem. 66: pp. 638–641. doi:.
Véase también
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.