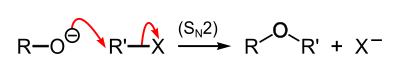
- Síntesis de Williamson
-
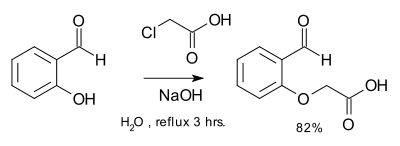 Síntesis de un éter mediante una reacción de salicilaldehído con ácido cloroacético y hidróxido de sodio[1]
Síntesis de un éter mediante una reacción de salicilaldehído con ácido cloroacético y hidróxido de sodio[1]
La síntesis de Williamson es una reacción orgánica que transcurre a través del mecanismo SN2 reaction, por la cual se forma un éter a partir de un haloalcano primario y un alcóxido (o un alcohol en un medio básico) . Fue desarrollada por el químico inglés Alexander Williamson en 1850 y es muy importante ya que ayudó a probar la estructura de los éteres, además de que es el método más sencillo para formar estos.[2]
Esta reacción implica el ataque de un ion de alcóxido hacia el haloalcano. Como disolvente se puede emplear el alcohol del que deriva el alcóxido, pero mejora el rendimiento de la reacción si utilizamos disolventes apróticos como DMF, DMSO.
El mecanismo general de la reacciones el siguiente:[3]Un ejemplo es la reacción de etóxido de sodio con cloroetano para formar éter etílico y cloruro de sodio:
- Na+C2H5O− + C2H5Cl → C2H5OC2H5 + Na+Cl−
Contenido
Campo
La reacción de Williamson cubre un vasto campo, es ampliamente usada tanto en síntesis industriales como de laboratorio, y se mantiene como el método más simple y popular de preparar éteres, ya sea si se trata de éteres simétricos o asimétricos. La reacción intramolecular de las halohidrinas en particular, produce epóxidos.
En el caso de éteres asimétricos hay dos posibilidades para la eleccción de los reactivos, y una es usualmente preferible en lugar de las bases de disponibilidad o rectividad. La reacción de Williamson es también usada frecuentemente para preparar un éter indirectamente a partir de dos alcoholes. Uno de los alcoholes es primeramente convertido en un grupo saliente (generalmente tosilo), luego ambos reaccionan juntos.
El alcóxido puede ser primario, secundario o terciario, mientras que por otro lado se prefiere que el agente alquilante sea primario. Los agentes alquilantes secundarios también reaccionan, pero los terciarios son usualmente muy propensos a provocar reacciones secundarios como para ser de uso práctico. Lo normal es que el grupo saliente sea un haluro o un éster de sulfonato que esté sintetizado para el cumplir el propósito de la reacción. Debido a que las condiciones de la reacción son bastante fuertes, se usan con frecuencia grupos protectores que pacifican otras partes de las moléculas que reaccionan. (como alcoholes, aminas, etc.)
Condiciones
Ya que los alcóxidos son altamente reactivos, estos son frecuentemente preparados justo antes de comenzar la reacción, o son generados in situ. En química de laboratorio, la generación in situ es llevada acabo generalmente mediante el uso de un carbonato o hidróxido de potasio, mientras que en la síntesis industrial es muy común la catálisis de transferencia de fase. Pueden usarse un amplio rango de solventes, pero los solventes próticos y los solventes polares tienden volver muy lento el proceso de la reacción, como resultado de la ralentización de la los nucleófilos libres. Por esta razón, el acetonitrilo y la N,N-Dimetilformamida son bastante usados.
Una reacción de Williamson típica es llevada a cabo de 50 a 100°C y es completada en un tiempo de una a ocho horas. Normalmente la desaparición completa de los materiales iniciales es difícil de conseguir, y son comunes las reacciones secundarias. En síntesis de laboratorio se logra generalmente un rendimiento de 50 a 95%, mientras que las cercanas conversiones cuantitativas pueden ser logradas en procedimientos industriales.
La catálisis usualmente no es necesarias en síntesis de laboratorio. Sin embargo, si un agente alquilante no reactivo es usado (como el cloruro de alquilo), entonces puede aumentar enormemente la velocidad de la reacción mediante la adición de una cantidad catalítica de una sal de yoduro soluble (la cual experimenta un intercambio de haluro con el cloruro para obtener un yoduro mucho más reactivo, una variante de la reacción de Finkelstein). En casos extremos, pueden ser añadidas sales de plata, como el oxido de plata por ejemplo:[4]
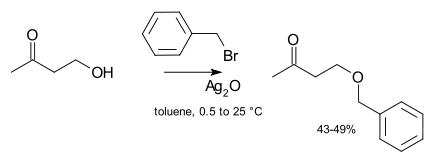
El ion de plata se coordina con el grupo saliente de haluro para hacer su salida más sencilla. Finalmente, algunas veces se usa la catálisis de transferencia de fase (como bromuro de tetra-n-butilamonio o 18-corona-6) a fin de incrementar la solubilidad del alcóxido ofreciendo un contraión más suave.
Reacciones secundarias
La reacción de Williamson con frecuencia participa junto con la eliminación catalizada por bases de los agentes alquilantes,[3] y la naturaleza de los grupos salientes tanto como las condiciones de la reacción (particularmente la temperatura y los solventes) pueden tener un fuerte efecto sobre las reacciones que favorecen. Algunas estructuras de agentes alquilantes pueden ser particularmente propensas a ser eliminadas.
Cuando el nucleófilo es un ion de aróxido, la reacción de Williamson puede participar además junto con la alquilación sobre el anillo, ya que el aróxido es un nucleófilo que puede atacar desde dos a más sitios, lo que resulta en la producción de dos a más productos.
Referencias
- ↑ Organic Syntheses, Coll. Vol. 5, p.251 (1973); Vol. 46, p.28 (1966) Link
- ↑ «Theory of Aetherification». Philosophical Magazine 37: pp. 350–356. 1850. ([1])
- ↑ a b Boyd, Robert W.; Morrison, Robert (1992). Organic chemistry. Englewood Cliffs, N.J: Prentice Hall. pp. 241–242. ISBN 0-13-643669-2.
- ↑ Organic Syntheses, Coll. Vol. 7, p.386 (1990); Vol. 60, p.92 (1981). Link
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.