- Apilamiento
-
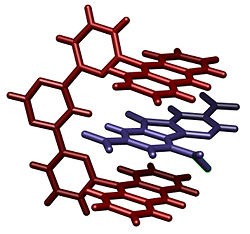
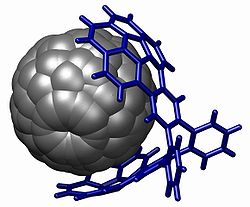 Estructura cristalina de un fulereno atrapado en un buckycatcher a través de interacciones aromáticas de apilamiento. Reportado por Sygula y colaboradores.[2]
Estructura cristalina de un fulereno atrapado en un buckycatcher a través de interacciones aromáticas de apilamiento. Reportado por Sygula y colaboradores.[2]
En química supramolecular, el apilamiento se refiere a un ordenamiento en pila, frecuentemente de moléculas aromáticas, que es adoptado debido a interacciones interatómicas. El ejemplo más común de un sistema apilado se encuentra en los pares de bases consecutivos de ADN. El apilamiento también se encuentra frecuentemente en proteínas, donde dos anillos relativamente no polares se ubican uno sobre otro. El origen de las fuerzas intermoleculares que contribuyen al apilamiento es materia de debate.
Contenido
Fuerzas que controlan el apilamiento
El apilamiento es referido frecuentemente como una interacción π-π, aunque los efectos debido a la presencia de un orbital π son sólo una fuente de tales interacciones, y en muchos casos no parece ser el contribuyente dominante.
En los sistemas de anillos con menos de tres anillos, los cálculos ab initio sugieren que la aromaticidad contribuye poco a las interacciones de apilamiento, y que la fuerza de estas interacciones, que estabiliza la conformación apilada, no difiere significativamente de las fuerzas de van der Waals, también experimentadas por moléculas saturadas de tamaño similar cuando están apiladas. En consecuencia, las nucleobases de ADN (que tienen uno o dos anillos) probablemente no estabilizan significativamente a la estructura apilada de ADN como resultado de su aromaticidad, sino por las fuerzas intermoleculares experimentadas por todas las moléculas neutras de capa cerrada.
Para sistemas de anillos más grandes (talvez de doce o más átomos), parece haber tal efecto π-π, causado por una contribución más grande dependiente del orbital (no se emparejan los átomos) al componente de dispersión de la fuerza de van der Waals, que en una molécula saturada equivalente. Esta contribución va a la par con el apilamiento óptimo de los orbitales π, minimizando la 'repulsión' de intercambio debida a razones geométricas. Realmente, las fuerzas electrostáticas debilitan considerablmente este efecto en los aromáticos, aunque no lo cancelan completamente, mientras que el componente inductivo de las fuerzas de van der Waals no hace una contribución significativa.
El resto de este artículo no ha sido actualizado para reflejar esta investigación.[3]
Apilamiento dentro de la química supramolecular
En química supramolecular, una interacción aromática (o interacción π-π) es una interacción no covalente entre compuestos orgánicos que contienen entidades aromáticas. Las interacciones π-π son causadas por el traslape intermolecular de los orbitales p en los sistemas conjugados π, así que se hacen más fuertes conforme el número de electrones π se incremente. Otras interacciones no covalentes incluyen al enlace de hidrógeno, fuerzas de van der Waals, interacciones de transferencia de carga, e interacciones dipolo-dipolo.
Las interacciones π-π actúan fuertemente en hidrocarburos aromáticos policíclicos. Esta interacción, que es un poco más fuerte que otras interacciones no covalentes, juega un rol importante en varias partes de la química supramolecular. Por ejemplo, las interacciones π-π tienen un efecto grande en las estructuras de los cristales basados en moléculas de compuestos aromáticos.
Una demostración potente del apilamiento se encuentra en el buckycatcher esquematizado abajo.[2] Esta pinza molecular se basa en dos buckyboles con un encaje perfecto para una molécula convexa de fulereno. La complexación tiene lugar simplemente por evaporación de una solución de tolueno que contiene ambos compuestos. En solución, se ha medido una constante de asociación de 8600 M-1, basado en cambios en los desplazamientos químicos de RMN.
Apilamiento en biología
En el ADN, el apilamiento π se da entre nucleótidos adyacentes y suma en la estabilidad de la estructura molecular. Las bases nitrogenadas de los nucleótidos están hechas de anillos de purina o pirimidina, consistentes ambos de anillos aromáticos Dentro de la molécula de ADN, los anillos aromáticos se ubican casi perpendicularmente a la dimensión longitudinal de las hebras de ADN. En consecuencia, las caras de los anillos aromáticos están alineados paralelamente unos a otros, permitiendo que las bases participen en interacciones aromáticas. A través de estas interacciones aromáticas, los enlaces π se extienden de los átomos participantes en los enlaces dobles, se traslapan con los enlaces π de las bases adyacentes. Éste es un tipo de enlace químico no covalente. Aunque un enlace no covalente es más débil que un enlace covalente, la suma de todas las interacciones de apilamiento π dentro de la molécula de doble hebra del ADN crean una gran red de energía estabilizante.
Usos en materiales
Muchos cristales líquidos discóticos pueden formar estructuras columnares por medio de interacciones π-π. Además, las interacciones π-π son un factor importante en las técnicas de autoensamblado molecular en nanotecnología
Interacción de apilamiento aromático
La interacción de apilamiento aromático algunas veces denominado apilamiento fenilo es un fenómeno en química orgánica que afecta a los compuestos aromáticos y a los grupos funcionales. Debido a las fuerzas de van der Waals sumamente fuerte entre las superficies de los anillos aromáticos planos, estos grupos en diferentes moléculas tienden a colocarse como en una pila de monedas. Este comportamiento enlazante afecta las propiedades de polímeros tan diversos como las aramidas, poliestirenos, ADN, ARN, proteínas, y péptidos. Este efecto puede ser explotado en sensores de gas para detectar la presencia de químicos aromáticos.
Apilamiento en T
Un efecto relacionado denominado apilamiento en T es observado frecuentemente donde un átomo de hidrógeno cargado positivamente de un sistema aromático apunta perpendicularmente al centro de otro plano aromático de otro sistema aromático. Esto se conoce también como interacción borde-cara.
Véase también
Enlaces externos
Referencias
- ↑ A. Petitjean, R. G. Khoury, N. Kyritsakas and J. M. Lehn (2004). «Dynamic Devices. Shape Switching and Substrate Binding in Ion-Controlled Nanomechanical Molecular Tweezers». J. Am. Chem. Soc. 126 (21): pp. 6637–6647. doi:.
- ↑ a b A. Sygula, F. R. Fronczek, R. Sygula, P. W. Rabideau and M. M. Olmstead (2007). «A Double Concave Hydrocarbon Buckycatcher». J. Am. Chem. Soc. 129 (13): pp. 3842–3843. doi:.
- ↑ Angew. Chem. Int. Ed. 2008, 47, 3430 - 3434
Wikimedia foundation. 2010.