- Ácido hidroxámico
-
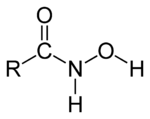
En química orgánica, un ácido hidroxámico es una clase de compuestos químicos que comparten el mismo grupo funcional, en el que un grupo hidroxilamino está insertado en un ácido carboxílico. Su estructura general es R-CO-NH-OH, con R como residuo orgánico, CO como un grupo carbonilo, y un grupo hidroxilamino NH-OH. Son usados como agentes quelantes de metales.[1] [2] [3] [4] [5] [6] [7]
Los ácidos hidroxámicos pueden ser sintetizados a partir de aldehídos, por medio de la reacción de Angeli-Rimini. Una reacción bien conocida de los ácidos hidroxámicos es el rearreglo de Lossen.
Los hidroximatos, sales de los ácidos hidroxámicos, son factores de crecimiento esenciales, o vitaminas, para algunos microbios. Su función es la de unirse a compuestos de hierro (sideróforos) que solubilizan el hierro y lo transportan a la célula.[8]
El hierro es un componente clave de los citocromos y proteínas hierro-azufre (involucradas en el transporte de electrones) y, en consecuencia, es importante en la respiración celular. En un ambiente ausente de oxígeno (anóxico), el hierro estará presente en el estado de oxidación +2 (Fe2+), que es soluble en agua. Bajo condiciones óxicas, el hierro estará presente en el estado de oxidación +3 (Fe3+), una forma mineral insoluble. Las potentes propiedades quelantes del ácido hidroxámico y sus derivados son explotadas por las bacterias para obtener hierro férrico. Una vez que el complejo hierro-hidroxamato ha entrado a la célula, el hierro es liberado, y el ácido hidroxámico puede ser excretado y reutilizado para el transporte de hierro.
Referencias
- ↑ Barocas, A.; F. Baroncelli, G. B. Biondi, G. Grossi (1966-12). «The complexing power of hydroxamic acids and its effect on behaviour of organic extractants in the reprocessing of irradiated fuels--II : The complexes between benzohydroxamic acid and thorium, uranium (IV) and plutonium (IV)». Journal of Inorganic and Nuclear Chemistry 28 (12): pp. 2961-2967. doi:. ISSN 0022-1902. http://www.science-direct.com/science/article/B758S-48GWMMM-8P/2/0e24f83e069f7473d7b0663eea4f8302.
- ↑ Baroncelli, F.; G. Grossi (1965-05). «The complexing power of hydroxamic acids and its effect on the behaviour of organic extractants in the reprocessing of irradiated fuels--I the complexes between benzohydroxamic acid and zirconium, iron (III) and uranium (VI)». Journal of Inorganic and Nuclear Chemistry 27 (5): pp. 1085-1092. doi:. ISSN 0022-1902. http://www.science-direct.com/science/article/B758S-48N50RN-2W/2/fc4a67c10211cd748add5daa51bb55ff.
- ↑ Fouché, K. F.; H. J. le Roux, F. Phillips (1970-06). «Complex formation of Zr(IV) and Hf(IV) with hydroxamic acids in acidic solutions». Journal of Inorganic and Nuclear Chemistry 32 (6): pp. 1949-1962. doi:. ISSN 0022-1902. http://www.science-direct.com/science/article/B758S-48M3JS8-NH/2/906cec1e859eacb47bf1f0efcd27e5cc.
- ↑ Agrawal, Y K (1979). «Hydroxamic Acids and Their Metal Complexes». Russian Chemical Reviews (10): pp. 948. doi:.
- ↑ Al-Jarrah, R. H.; A. R. Al-Karaghouli, S. A. Al-Assaf, N. H. Shamon (1981). «Solvent extraction of uranium and some other metal ions with 2-N-butyl-2-ethyl octanohydroxamic acid». Journal of Inorganic and Nuclear Chemistry 43 (11): pp. 2971-2973. doi:. ISSN 0022-1902. http://www.science-direct.com/science/article/B758S-48M3SCR-152/2/723dc6c17d83f6266314116734ae71e8.
- ↑ Gopalan, Aravamudan S.; Vincent J. Huber, Orhan Zincircioglu, Paul H. Smith (1992). «Novel tetrahydroxamate chelators for actinide complexation: synthesis and binding studies». Journal of the Chemical Society, Chemical Communications (17): pp. 1266-1268. http://dx.doi.org/10.1039/C39920001266.
- ↑ Koshti, Nirmal; Vincent Huber, Paul Smith, Aravamudan S. Gopalan (28-02-1994). «Design and synthesis of actinide specific chelators: Synthesis of new cyclam tetrahydroxamate (CYTROX) and cyclam tetraacetonylacetone (CYTAC) chelators». Tetrahedron 50 (9): pp. 2657-2664. doi:. ISSN 0040-4020. http://www.sciencedirect.com/science/article/B6THR-42GDT5D-8H/2/4625c55f99ae5f042ca3387e0fe7386c.
- ↑ Miller, Marvin J. (November 1989). «Syntheses and Therapeutic Potential of Hydroxamic Acid Based Siderophores and Analogues». Chemical Reviews 89 (7): pp. 1563–1579. doi:. http://pubs.acs.org/doi/abs/10.1021/cr00097a011.
Categorías:- Ácidos
- Grupos funcionales
- Compuestos de nitrógeno
Wikimedia foundation. 2010.