- Nitropropano
-
El 1-nitropropano y el 2-nitropropano son compuestos orgánicos pertenecientes a la serie homóloga de los nitroderivados. Son líquidos incoloros, de olor etérico característico. Se emplean como disolventes, aditivos para la gasolina y compuestos intermediarios para sintetizar insecticidas, colorantes y otras sustancias orgánicas. Tienen una toxicidad elevada.
Contenido
Síntesis
Se obtienen por reacción del ácido nítrico con vapores de propano a 400 °C y una presión de 8-12 atm, obteniendose una mezcla de 2-nitropropano (46%), nitrometano (28%), y cantidades menores de 1-nitropropano y nitroetano.[1]
Propiedades
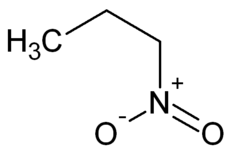
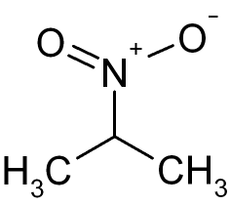
Derivados del propano con el grupo nitro (NO2-) Propiedad 1-nitropropano[2] 2-nitropropano[3] [4] Estructura química: Otros nombres: Nitroparafina Isonitropropano
Nitroparafina
NiPar S-20; NiPar S-30Fórmula química: CH3-CH2-CH2-NO2 CH3-CH(NO2)-CH3 Estado físico Líquido Líquido Aspecto Incoloro Incoloro, aceitoso Masa molecular: 89,09 g/mol 89,09 g/mol Nº CAS: 108-03-2 79-46-9 Punto de fusión:°C -108 °C -93 a -91 °C Punto de ebullición: 132 °C 120 °C Densidad: 0,99 g/mL 0,99 g/mL Punto de inflamación: 36 °C 24 °C Viscosidad (a 25 °C): 0,746 mPas Presión de vapor (a 20 °C): 17,3 hPa Densidad óptica (nD20)
Índice de refracción:1,3944 Nº RTECS: TZ5075000 TZ5250000 Solubilidad en agua: 14 g/l (25 °C) 17 g/l (25 °C) Código NFPA Pictograma de riesgo químico
Xn T
TFrases R R10 R20/21/22 R45 R10 R20/22 Frases S S2 S9 S53 S45 Peligros químicos Se descompone por calentamiento
produciendo humos tóxicos.Riesgos Inflamable.
Por encima de 20 °C se evapora
y sus vapores son nocivos.Inflamable.
Muchas reacciones pueden producir
incendios y explosiones.
Al arder genera humos tóxicos.
Puede causar cáncer.Temperatura de autoignición 421 °C 425-428 °C Coeficiente de reparto octanol-agua, POW 0,93 Límites de explosividad (% vol. aire) 2,2- 2,6-11 Usos
Los nitroalcanos sufren hidrólisis en presencia de ácidos minerales fuertes. Sometiendo el 1-nitropropano a este tratamiento se convierte en el ácido hidroxámico y posteriormente se rompe el enlace C-N, obteniéndose finalmente ácido propanoico e hidroxilamina (NH2OH). Esta reacción se emplea para la síntesis industrial de este últimocompuesto.[5]
El 2-nitropropano se emplea en la industria de las gomas, fabricación de lacas, fabricación de tintes y síntesis de productos orgánicos.
Toxicidad
Poseen una intensa acción irritante sobre las mucosas por lo que provocan afecciones renales y hepáticas. El 1-nitropropano parece menos tóxico que el 2-nitropropano, siendo sus valores de concentraciones admisibles medias de 25 ppm y 10 ppm respectivamente.
El 2-nitropropano ha provocado carcinomas hepáticos en ratas por lo que se le considera un carcinógeno para los seres humanos. Se han descrito cuatro casos de intoxicación por inhalación de nitropropano en un espacio confinado, con desenlace fatal.[6] Hay que evitar que se acumule en la atmósfera de lugares de trabajo, siendo el tolueno muy eficaz en la captación del 2-nitropropano.[7]
Referencias
- ↑ Informacion Tecnologica. Vol. 5, N.º 2. 1994. ISSN 0716-8756. Centro de Informacion Tecnologica. Pág. 75
- ↑ Ficha de seguridad de 1-nitropropano. Instituto nacional de seguridad e higiene en el trabajo (INSHT). Ministerio de Trabajo y Asuntos Sociales. España.
- ↑ Ficha de seguridad de 2-nitropropano. Instituto nacional de seguridad e higiene en el trabajo (INSHT). Ministerio de Trabajo y Asuntos Sociales. España.
- ↑ Ficha de seguridad de 2-nitropropano. Scharlau.
- ↑ Manual de química orgánica. Hans Beyer, José Barluenga Mur, Wolfgang Walter. Editorial Reverté, 1987. ISBN: 8429170669. Pág. 170
- ↑ Toxicología industrial e intoxicaciones profesionales. Robert R. Lauwerys. Elsevier España, 1994. ISBN: 8431106670. Pág. 282
- ↑ Periago Jiménez, J.F.; González Ferradas, E. Estudio experimental sobre la captación de 2-nitropropano en aire. Fundación Mapfre. En: Temas de seguridad e higiene del trabajo. Madrid, Mapfre, 1984, p.431-58.
Categoría:- Nitroderivados
Wikimedia foundation. 2010.