- Marburgvirus
-
Marburg virus
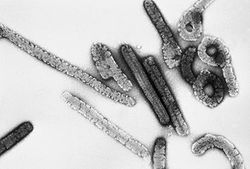
Marburg virus particles, approx. 100,000x magnificationClasificación de los virus Grupo: V (Virus ARN monocatenario negativo) Orden: Mononegavirales Familia: Filoviridae Género: Marburgvirus Especies Lake Victoria Marburgvirus
El género Marburgvirus o virus de Marburgo agrupa a filovirus pertenecientes a la familia Filoviridae y alberga al responsable de una fiebre hemorrágica viral de elevada mortalidad: la fiebre hemorrágica de Marburgo.
Contenido
Epidemiología
El virus toma su nombre de la ciudad alemana de Marburgo, donde fue aislado en 1967 tras una epidemia de fiebre hemorrágica que cundió en el personal de laboratorio encargado de cultivos celulares que había trabajado con riñones de simios verdes ugandeses (Cercopithecus aethiops) importados hacía poco, que luego resultaron estar infectados. En total enfermaron 37 personas. 25 casos ocurrieron entre el personal del laboratorio, por contacto directo con los monos. 7 de estos murieron. Los otros casos comprendieron dos médicos (infectados al pincharse accidentalmente con las jeringuillas que utilizaron para extraer sangre a los miembros del personal del laboratorio), una enfermera, un ayudante de autopsias y la esposa de un médico veterinario. En todos estos casos el contagio se produjo un contacto directo con una persona infectada.
En 1975, en Johannesburgo, Sudáfrica, fue hospitalizado un varón australiano de 20 años a su regreso de un largo viaje a Zimbabue durante el cual había acampado al aire libre en diversas ocasiones. Todas las personas que entraron en contacto con él fueron puestas en aislamiento a fin de contener la infección. Sólo otras 2 personas enfermaron: una muchacha de 19 años que lo había acompañado en el viaje y una enfermera de 20 años que había atendido a ambos. Por desgracia, el hombre murió cuatro días después de ingresar. Las dos mujeres recibieron un tratamiento de apoyo intensivo y sobrevivieron.
El 8 de enero de 1980, en Kenia, enfermó Charles Monet, un francés de 56 años que, a pesar de los cuidados, falleció 7 días más tarde. Monet presentó fiebre repentina, seguida de cefalea, diarrea y vómitos. Se cree que Monet se contagió al visitar la cueva de Kitum, en el Monte Elgon, frecuentada por numerosas especies de animales que podrían ser reservorios del virus. El médico que había tratado de reanimar a Monet enfermó 9 días después logrando sobrevivir.
El 13 de agosto de 1987, también en Kenia, fue hospitalizado un muchacho danés de 15 años con un cuadro de cefalea, malestar general, fiebre y vómitos, de tres días de duración. A pesar de la intensa terapia de apoyo, murió al undécimo día de enfermedad. También había visitado la cueva de Kitum.
Entre 1998 y 2000 hubo una epidemia en la República Democrática del Congo, con 154 personas enfermas de las que murieron 128 (mortalidad del 83%). La mayor parte de los casos ocurrió entre mineros de la mina de oro de Durba, en el noroeste del país, y luego en la aldea vecina de Watsa. La transmisión secundaria fue escasa, aunque es contagiaron algunos familiares que participaron directamente en el cuidado de los pacientes. Análisis virológicos que se realizaron a continuación indicaron que se habían introducido cepas virales de diversos tipos, pero no se identificó la fuente.
Entre 2004-2005 se dio en Angola el que acabaría siendo el mayor brote de fiebre hemorrágica de Marburgo de la historia. Se originó en la provincia de Uíge en octubre de 2004. Tras identificarse el último caso confirmado en laboratorio, en julio de 2005, el Ministerio de Salud había notificado en total 374 casos, incluidas 329 defunciones (tasa de mortalidad del 88%) en todo el país. 368 casos (incluidas 323 muertes) se notificaron en la Provincia de Uige. Todos los casos localizados en otras provincias fueron relacionados directamente con este brote.
Entre junio y agosto de 2007 en Uganda se confirmaron tres casos entre mineros de Kamwenge, en el oeste del país. Dos de los mineros desarrollaron la enfermedad tras atender a su compañero, y uno de ellos falleció.
En julio de 2008 una turista holandesa desarrolló la enfermedad cuatro días después de volver a los Países Bajos tras tres semanas de vacaciones en Uganda. No se ha podido confirmar la fuente de exposición, pero se sabe que la mujer visitó varias cuevas habítadas por murciélagos.
Se cree que la fiebre de Marburgo puede ser una zoonosis, pero por el momento todavía no se identifica el depósito del virus, a pesar de que se han tomado en consideración muchas especies animales. Se cree que el virus de Marburgo pueda ser endémico en muchas áreas de África Central. Se discute todavía la cuestión de si los filovirus pueden ser responsables de infecciones subclínicas.
Todos los grupos de edad son susceptibles de una infección, pero se cree que los más predispuestos son los adultos. Cabe notar, de todos modos, que antes se creía que los niños estaban poco expuestos (8% en la República Democrática del Congo), pero en la epidemia en Angola también ellos resultaron afectados.
La epidemia en Angola
En 2004, en Angola, estalló una nueva epidemia de fiebre hemorrágica de Marburgo. El brote se originó en la provincia de Uige y los informes finales refirieron 374 casos con 329 decesos. En Italia, esta epidemia causó ruido por la muerte de la pediatra Maria Bonino, trabajadora del hospital de Uige, muerta a los 51 años de edad.
El personal enviado por la Organización Mundial de la Salud fue retirado luego de los actos de violencia a los que había sido sometido por parte de los habitantes del lugar, frustrados por la poca eficacia de las curas y la preocupación por la enfermedad, tras lo cual. La principal línea de actuación fue un programa de prevención en las poblaciones locales. En particular los esfuerzos se encaminaron a ofrecer un equipo de protección adecuado a los familiares de los enfermos y al personal sanitario local y a instruir a éste último sobre la utilización de métodos que permitieran reducir el riesgo de infección en las prácticas quirúrgicas y de laboratorio cotidianas. Con este fin se movilizaron el gobernador de la provincia y los operadores sanitarios locales, que acudieron personalmente a visitar las comunidades afectadas por la epidemia. En la campaña de sensibilización ayudaron también los jefes religiosos.
Los efectos de esta labor de sensibilización se hicieron evidentes cuando los habitantes empezaron a señalar a los muertos y los casos de enfermedad sospechosos. Esto favoreció que los grupos de salud pudieron volver a realizar su trabajo.
El personal de la OMS, además, colaboró activamente con el equipo de Médicos Sin Fronteras, que aprestó, cerca de Uige, un centro de aislamiento adonde internar a los casos sospechosos.
Estructura del virus
El virus de Marburgo presenta la estructura clásica de los filovirus. El virión presenta una morfología irregular (pleomórfica), pues tiene forma de bastoncillo de longitud variable entre los 800 y los 1400 nm y con un diámetro de alrededor de 80 nm. En ocasiones pueden también tener forma circular, de U o de 6.
La nucleocápside presenta, en su interior, una molécula de ARN de polaridad negativa, y la envoltura viral tiene una simetría helicoidal. El todo está cubierto por una envoltura lipídica que proviene de la membrana de la célula hospedadora, de la cual salen proyecciones (peplómeros) de alrededor de 7 nm entre las que media un espacio de 10 nm. Dichas proyecciones tienen forma globular y están formadas de homotrímeros de la glicoproteína de superficie.
El genoma del virus es de alrededor de 19 Kb y parece contener el código de 7 productos; el genoma presenta una disposición lineal de los genes con una zona de superposición. La estructura del genoma es la siguiente:
- Región 3’ no traducida
- Nucleoproteína (NP)
- VP35
- VP40
- Glicoproteína
- VP30
- VP24
- Proteína L (una ARN polimerasa ARN dependiente)
- Región 5’ no traducida
El área de superposición se sitúa entre los genes VP30 y VP24 (en el genoma del virus Ébola hay 3 áreas de superposición).
La nucleoproteína tiene un peso molecular de 95 Kd y está inserta en el virión de forma fosforilada. Parece poder pegarse al ARN y ser el componente más importante del complejo riboprotéico que forma de la envoltura nuclear.
La glicoproteína de superficie contiene un dominio hidrofóbico C-terminal que le permite engancharse a la membrana. Ésta contiene N-glicanos y O-glicanos que constituyen más del 50% del peso de la proteína. Las áreas N- y C- terminales son altamente conservadas y ricas en residuos de cistina, mientras que la parte central es hidrofílica y contiene los sitios de enganche de los glicanos. La glicoproteína media la adhesión con el receptor de la célula hospedadora y la sucesiva fusión entre las membranas lipídicas, permitiendo el fenómeno de la infección.
Se cree que la proteína es una ARN polimerasa ARN dependiente y, en efecto, presenta áreas de homología con otras ARN polimerasas de virus de ARN, situadas sobre todo a la mitad de la N-terminal.
La función de las proteínas VP35 y VP30 todavía no está muy clara. Se cree que posiblemente formen parte de la envoltura nuclear. Las proteínas VP24 y VP40 son ricas en áreas hidrofóbicas y se cree que forman parte de la envoltura proteica.
Replicación viral
El ingreso del virus a la célula hospedante es mediado por la glicoproteína de superficie, pero no se conoce el receptor al que se pega. Hay quien sostiene incluso que los receptores a los que se pega la glicoproteína pueden ser de distintos tipos. Asimismo, se desconoce si el virus penetra a través de la fusión de la membrana o si a esto se agrega también un proceso de endocitosis.
El virus de Marburgo es capaz de infectar casi todos los órganos (de los linfoides hasta el encéfalo). La transcripción y replicación del virus ocurre en el citoplasma de la célula hospedadora. Se cree que el filamento de ARN se transcribe, gracias a la polimerasa, en una molécula de ARN, complementaria a la nativa, que luego se sobrepone por poliadenilación en la terminal 3’ y, quizás, por inserción de una secuencia externa de la cola 5’. Este ARN se usa después cual molde para la traducción y la formación de las proteínas y para la replicación del genoma.
Anatomía patológica
Es común la presencia de necrosis focales de hígado, nódulos linfáticos, testículos, ovarios, pulmones, riñones y órganos linfoides.
En el hígado se localizan cuerpos eosinófilos (similares a los cuerpos de Councilman) y en el pulmón se notan indicios de pulmonitis intersticial y de endoarteritis de las arterias pequeñas.
La necrosis focal de los órganos linfoides es bastante característica, mientras que la necrosis tubular renal ocurre sobre todo en las últimas fases de enfermedad.
En el sistema nervioso hay infartos hemorrágicos múltiples y proliferación de las células de la glía.
En los vasos sanguíneos se han encontrado depósitos de fibrina; sin embargo, no está claro si puede haber una coagulación intravasal diseminada, pues no siempre hay signos de laboratorio en ese sentido. Se han localizado antígenos antivirales en varios órganos, sobre todo en el hígado, en los riñones, en el bazo y en las hipófisis. En los supervivientes, además, el virus ha sido aislado en la cámara anterior del ojo (hasta 4-5 semanas después de la enfermedad) y en el líquido seminal (hasta la duodécima semana).
Patogénesis
Por el momento no están claros los fenómenos fisiopatológicos. La controversia en torno a la presencia de un estado de coagulación intravasal sugiere que pueden estar activos también mediadores específicos. Por el momento no han sido identificados y no dejan de ser meras hipótesis: la participación de los macrófagos mediante la producción de proteasas, H2O2 y citocinas varias (tipo TNF-α). En efecto, el uso de un sobrenadante, obtenido de cultivos in vitro de monocitos/macrófagos incubados con filovirus, sobre células endoteliales ha determinado un aumento de su permeabilidad. El sobrenadante en cuestión ha resultado rico en TNF-α. Se supone, pues, que los fenómenos hemorrágicos se deban al daño de las células endoteliales causado, ya por la replicación directa del virus, ya por la coparticipación de mediadores producidos por células activadas.
Se han observado también anormalidades plaquetarias y de los granulocitos. Pueden aparecer también linfocitos atípicos y neutrófilos con la anormalidad de Pelger-Huet.
Modalidades de contagio
La transmisión interhumana es la principal forma de contagio de la gente. Esto ocurre al entrar en contacto cercano con el enfermo. En particular, el contagio se da a través de los líquidos del cuerpo: sangre, saliva, vómito, heces, orina y secreciones respiratorias. La transmisión por vía sexual es posible durante varias semanas después de la enfermedad. El pico de máxima infectividad ocurre durante las manifestaciones más graves de la enfermedad, junto con las manifestaciones hemorrágicas. El virus también puede inocularse a través de instrumentos contaminados.
Clínica
El periodo de incubación de la enfermedad es de alrededor de 3 a 9 días, pasados los cuales aparece una cefalea frontal y temporal acompañada de malestar general y mialgias. Es característica la fiebre alta (39-40 °C) que aparece ya desde el primer día de enfermedad, a la que sigue una fuerte y rápida debilitación. Cerca de la mitad de los enfermos pueden acusar conjuntivitis.
Hacia el tercer día aparece diarrea acuosa con dolor abdominal y calambres, náusea y vómito. La diarrea puede ser también grave y durar hasta una semana. En este periodo los enfermos presentan un rostro inexpresivo con ojos hundidos y también letargo y alteraciones mentales.
En la primera semana puede haber también linfoadenopatía cervical y aparición de enantema de las amígdalas y del paladar. Signo característico es la aparición de un exantema máculo-papuloso no pruriginoso que aparece, en general desde el quinto día, en rostro y cuello y que sucesivamente se extiende a los miembros.
Las manifestaciones hemorrágicas aparecen a partir del quinto día de enfermedad. En general la muerte acaece por colapso cardiocirculatorio a causa de sangrados múltiples. Se puede encontrar sangre en el vómito y tener sangrados de nariz, de encías o de vagina. Un problema grave puede ser el sangrado abundante causado por la punción de agujas.
Pasada la primera semana, la fiebre empieza a bajar para luego reaparecer a los 12 o 14 días de enfermedad. En la segunda semana pueden aparecer también hepatosplenomegalia, edema facial o escrotal.
Generalmente el fallecimiento ocurre sobre todo entre el octavo o noveno día y el día 16 a causa de las hemorragias continuas. Son posibles complicaciones de la enfermedad la orquitis (hasta la atrofia testicular), la miocarditis y la pancreatitis.
En caso de que la persona sobreviva la convalecencia, sigue durante 3 a 4 semanas con pérdida del cabello, anorexia y disturbios psicóticos. A veces pueden aparecer mielitis transversa y uveítis.
Alteraciones de laboratorio
Se verifica muy pronto, aun desde el primer día, una leucopenia con linfocitos que llegan hasta los 1000/μl; hacia el cuarto día se agrega una neutropenia. Entre el sexto y duodécimo día aparece una plaquetopenia importante (hasta menos de 10000 plaquetas/μl). Se desarrollan también alteraciones consiguientes al sufrimiento de varios órganos: hipoproteinemia, aumento de las enzimas aminotransferasa, proteinuria y aumento de la azoemia. En los casos mortales se puede notar presencia de coagulación intravascular diseminada.
Diagnóstico
El diagnóstico se basa esencialmente en el decurso clínico y en los datos epidemiológicos. Un diagnóstico específico se basa en el aislamiento del virus o bien en la evidencia de la respuesta inmunitaria y en la presencia de material genómico viral. Para evidenciar la presencia de anticuerpos (IgM y IgG) se recurre a un ensayo de inmunofluorescencia indirecta, al uso de la prueba Western blot o de la prueba ELISA. Para distinguir el genoma o los antígenos virales se utiliza la reacción en cadena de la polimerasa (PCR), la inmunofluorescencia, la histoquímica o la prueba ELISA.[1]
Terapia
No existe terapia específica. Hay que recurrir a una terapia de apoyo para controlar el volumen hemático, el balance electrolítico y monitorear atentamente la presencia de infecciones secundarias. Sólo en caso de que se note un estado de coagulación intravasal diseminada se puede recurrir a la heparina. Se han propuesto terapias a base de suero obtenido de sujetos curados o con interferón, pero actualmente faltan pruebas de apoyo. La ribavirina, en experimentos in vitro, no ha podido reducir la replicación del virus de Marburgo.[1]
Es importante el aislamiento del paciente y el uso de dispositivos de protección para el personal médico y enfermeril. Actualmente se realizan estudios para poder crear una vacuna específica.[2]
Fuentes
- ↑ Daddario-DiCaprio KM, Geisbert TW, Ströher U, et al.. «Postexposure protection against Marburg haemorrhagic fever with recombinant vesicular stomatitis virus vectors in non-human primates: an efficacy assessment». Lancet 367 (9520): pp. 1399–1404. doi:. http://www.thelancet.com/journals/lancet/article/PIIS0140673606685462/abstract.
- ↑ Jones SM, Feldmann H, Stroher U et al. (2005). «Live attenuated recombinant vaccine protects nonhuman primates against Ebola and Marburg viruses». Nature Med 11 (7): pp. 786–90. doi:. PMID 15937495.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre MarburgvirusCommons.
Wikimedia Commons alberga contenido multimedia sobre MarburgvirusCommons.- Página de la OMS
- Alibek, Ken. Biohazard
- Preston, Richard. The Hot Zone. ISBN 0-517-17158-9
- Garrett, Laurie. The Coming Plague. ISBN 0-374-12646-1
- McNeill. Plagas y Poblaciones. ISBN 0-8446-6492-8
- Center for Disease Control, Infection Control for Viral Haemorrhagic Fevers In the African Health Care Setting.
- Center for Disease Control, Marburg Haemorrhagic Fever.
- Center for Disease Control, Known Cases and Outbreaks of Marburg Hemorrhagic Fever
- World Health Organization, Marburg Haemorrhagic Fever.
- Red Cross PDF
Wikimedia foundation. 2010.
