- Factor de van't Hoff
-
Factor de van't Hoff
El factor de van't Hoff (por Jacobus Henricus van't Hoff) es un parámetro que indica la cantidad de especies presentes que provienen de un soluto tras la disolución del mismo en un solvente dado. Se lo denomina "
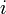 ".
".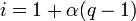
Muchos solutos al disolverse se disocian en dos o más especies, como en el caso de los compuestos iónicos. Entonces la concentración de especies en disolución no coincide con la del soluto, necesitamos un factor que al multiplicarlo por la concentración del soluto nos dé la concentración total de especies en disolución. Este dato es particularmente importante para la propiedades coligativas como los fenómenos de ósmosis, ya que la presión osmótica depende de la concentración de especies en la disolución y no de la concentración del soluto.
Si se disuelve, por ejemplo, 1 mol de NaCl en 1 litro de agua (sin llegar a la saturación) se puede decir que la concentración de NaCl es 1 M (1 molar). Pero al disolverse se generaran dos iones: un sodio monopositivo y un cloruro, por lo que la concentración de iones en el agua es el doble que la concentración de cloruro sódico. Aquí el
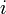 por tanto se aproxima a 2. Decimos que se aproxima sin llegar a ser 2 porque quedan aún moléculas completas de cloruro sódico sin disociar, aunque en muy pequeña proporción al ser éste muy soluble en agua y la concentración relativamente pequeña. Para una solución de Na2SO4, da un factor de 3 aproximadamente (dos cationes Na+ y un anión SO4-2, sulfato [VI]). La solución de un compuesto orgánico afín al agua, como la glucosa, no genera iones eléctricamente cargados, por lo tanto el factor de Van't Hoff se aproxima a 1, pues no se da ninguna disociación.
por tanto se aproxima a 2. Decimos que se aproxima sin llegar a ser 2 porque quedan aún moléculas completas de cloruro sódico sin disociar, aunque en muy pequeña proporción al ser éste muy soluble en agua y la concentración relativamente pequeña. Para una solución de Na2SO4, da un factor de 3 aproximadamente (dos cationes Na+ y un anión SO4-2, sulfato [VI]). La solución de un compuesto orgánico afín al agua, como la glucosa, no genera iones eléctricamente cargados, por lo tanto el factor de Van't Hoff se aproxima a 1, pues no se da ninguna disociación.En el caso de solutos que se disocian parcialmente, es necesario conocer la constante de disociación y calcular la concentración de cada especie en disolución, que sumadas nos dará la concentración total de las especies en disolución. Si queremos calcular el factor de van´t Hoff tendremos que dividir la concentración total de las especies en disolución entre la concentración de soluto.
En los cálculos, si no se dispone del valor real, se puede realizar la aproximación antes mencionada.
Categoría: Fisicoquímica
Wikimedia foundation. 2010.
