- Fenolftaleína
-
Fenolftaleína
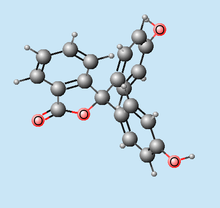 Fenolftaleína
Fenolftaleína
Nombre (IUPAC) sistemático 3,3-Bis(4-hidroxifenil)-1(3H)-isobenzofuranona Identificadores Número CAS 77-09-8 Código ATC A06AB04 A06AB04 PubChem ? ChEBI ? Datos químicos Fórmula C20H14O4 Peso mol. 318.327 g/mol Farmacocinética Biodisponibilidad ? Metabolismo N/A Vida media 8.6 horas Excreción Vía urinaria, 85% Heces Consideraciones terapéuticas Cat. embarazo ?
Estado legal Vías adm. Oral La fenolftaleína es un compuesto químico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3), en presencia de ácido sulfúrico.
Contenido
Descripción y usos
Es un liquido blanco oSirve tanto incoloro; sus cristales son incoloros y es insoluble en hexano sólido. Tiene un punto de fusión de 4° C. En química se utiliza como indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna color. En química se utiliza en análisis de laboratorio, investigación y química fina.
En análisis químico se usa como indicador de valoraciones ácido-base, siendo su punto de viraje alrededor del valor de pH, realizando la transición cromática de incoloro a rosado. El reactivo se prepara al 1% p/v en alcohól de 90° y tiene duración indefinida.
Farmacología
En farmacología y terapéutica se utiliza como laxante catártico. En México y otros países, a pesar de que se ha limitado su uso como medicamento dada la suposición de que tiene efectos cancerígenos, fue incorporado a la farmacopea homeopática y se sigue vendiendo en las farmacias como especialidad homeopática. En Chile se sigue vendiendo la presentación ética del medicamento[1] En análisis clínicos, la fenolftaleína se utiliza como agente de diagnóstico para investigar la función renal y en la determinación de orina residual en la vejiga. Aquí se usa una forma inyectable del fármaco.
Antecedentes
La acción catártica de la fenolftaleína fue descubierta de manera accidental. Hacia finales del siglo antepasado, el gobierno de Hungría, para ayudar a que su pueblo pudiera comprar vino barato, decretó que el vino adulterado fuera marcado con fenolftaleína, ya que en presencia de álcali se tornaba rojo brillante y se suponía que era inocuo. Pronto se vio que quienes tomaban la bebida sufrían de diarrea descubriéndose así un nuevo purgante.[2]
Acción
La acción del fármaco es semejante al grupo del antraceno y ejerce un efecto estimulante del peristaltismo intestinal por acción directa sobre las terminaciones nerviosas del colon. Como es un compuesto insoluble en agua pero que forma sales insolubles como los álcalis, su acción depende hasta cierto grado de la alcalinidad del tracto gastrointestinal.
Farmacocinética
Una dosis terapéutica pasa a través del estómago sin sufrir cambios y se disuelve en el intestino por la acción combinada de las sales biliares y del contenido intestinal alcalino. Cerca de un 15% se absorbe en la circulación; el resto aparece en las heces sin modificación. Una porción de la droga absorbida aparece en la orina, la cual, si se vuelve alcalina tendrá una coloración roja y otra porción se excreta de nuevo al tubo intestinal con la bilis lo que de nuevo aumenta la actividad intestinal y sus efectos se siguen notando 3 ó 4 días posteriores a su administración inicial. La acción se inicia pasadas 4 u 8 horas tras la administración oral y es eficaz como purgante mostrando poca acción cólica. A finales de los años sesenta e inicios de los setentas, se registraron aproximadamente 28 preparaciones farmacéuticas que contenían como ingrediente principal la fenolftaleína.
Efectos indeseables
A dosis elevadas y en personas susceptibles se puede presentar un efecto purgante excesivo, cólico, palpitaciones, respiración alterada y colapso. Se ha registrado un caso fatal por el uso de fenolftaleína[3]
Otras manifestaciones son dermatitis en forma de eritema multiforme o de placas maculares de color rosa que pueden llegar a ser púrpuras. Puede sentirse comezón y sensación de ardor quemante.
Se han sintetizado derivados de la fenolftaleína pero se encontró que la actividad catártica es mucho menor en aquellos derivados en los que la porción bencénica de la estructura carbonada se alargaba mediante sustitución o cuando la ftalida era reemplazada por ftalamida o por antrona.
Otros usos
La fenolftaleína se utiliza como reactivo en la Prueba de Kastle-Meyer, para detectar trazas de sangre.
Química
El cambio de color está dado por la siguiente ecuación química::
H2Fenolftaleína
Ácido
Incoloro↔ Fenolftaleína2-
Alcalino
Rosa↔ Fenolftaleína(OH)3-
Muy Alcalino
IncoloroEn soluciones fuertemente básicas, la fenolftaleína se torna incolora. En soluciones fuertemente ácidas es naranja. Por lo tanto tiene diferentes rangos de acción:
Especies In H2In In2− In(OH)3− Estructura 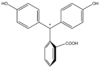
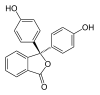
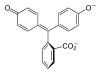
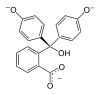
Modelo 
pH < 0 0−8.2 8.2−12.0 >12.0 Condiciones fuertemente ácidas ácidas o neutra alcalinas fuertemente alcalinas Color naranja incoloro rosa incoloro Imagen 

La fenolftaleína normalmente se disuelve en alcohol para su uso en experimentos. La fenolftaleína es un ácido débil que pierde cationes H+ en solución. La molécula de fenolftaleína es incolora, en cambio el anión derivado de la fenolftaleína es de color rosa. Cuando se agrega una base la fenolftaleína (siendo esta inicialmente incolora) pierde H+ formándose el anión y haciendo que tome coloración rosa.El cambio de color no puede explicarse solo en base a la desprotonación, se produce un cambio estructural con la aparición de una tautomería cetoenólica.
Precauciones
En personas con ictericia, la fenolftaleína carece de efecto. No deben tomarla niños menores de dos años. Puede ocurrir idiosincrasia al fármaco. Además es una sustancia cancerígena.
Presentaciones farmacéuticas
- Se puede encontrar en tabletas de 60 mg. Si se presenta de forma amarilla, es una forma menos purificada de la droga.
- Frasco de solución con 50 g.
- Solución indicadora al 1% de fenolftaleína.
Referencias
- ↑ Fenolftaleína en Laboratorio Valma Ltda.
- ↑ Farmacología Médica Drill, Sección Catárticos y Laxantes; autor: Desmond D. Bonnycastle.
- ↑ Un Ensayo Clínico de un Laxante de Contacto: Reporte de 250 casos en una Unidad Quirúrgica. Autor: K. T. Chan; Revista Médica de Singapur; pp 83-93, 1962
Categorías: Hidrocarburos aromáticos | Código ATC A | Laxantes de contacto | Indicador de pH
Wikimedia foundation. 2010.
