- Óxido de hierro (III)
-
Óxido de hierro (III)
Nombre (IUPAC) sistemático Trióxido de dihierro General Otros nombres Trióxido de dihierro
Óxido férrico
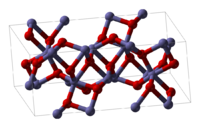
α-Fe2O3 (hematita), β-Fe2O3, γ-Fe2O3 (maghemita), ε-Fe2O3Fórmula semidesarrollada Fe2O3 Fórmula molecular n/d Identificadores Número CAS 1309-37-1 Propiedades físicas Estado de agregación Sólido Apariencia Polvo rojo Densidad 5242 kg/m3; 5,242 g/cm3 Masa molar 159.7 g/mol Punto de fusión 1838 K (1565 °C) Estructura cristalina Como el corindón Propiedades químicas Solubilidad en agua Insoluble Momento dipolar 0 D Compuestos relacionados Compuestos relacionados Óxido de hierro (II), Óxidos de hierro Peligrosidad NFPA 704 Riesgos Ingestión Peligroso, puede resultar en envenenamiento. Inhalación Venenoso, puede resultar en edema pulmonar. Piel Puede resultar en envenenamiento en caso de tratarse de material fundido. Ojos Puede causar irritación. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl óxido de hierro (III) (también conocido como óxido férrico) es uno de los óxidos de hierro, cuya fórmula es Fe2O3. En este compuesto, la valencia del hierro es +3. Este es el óxido de hierro "común" que aparece en el metal tras su exposición al aire durante tiempo. Tiene varias formas estructurales:
No posee brillo metálico.
No conduce la electricidad debido a la localización electrónica que existe en el centro metálico. Se impide la formación de bandas de conducción.
Puede darse semiconducción si se dan fenómenos de no estequiometría.
La variedad de colores del óxido de hierro (III) (azul, verde y violeta) que simula el atardecer, se debe principalmente a la habilidad del hierro de cambiar sus electrones en el penúltimo nivel de energía con modificación en el spin. De esto se intuye, que el camuflaje de los camaleones se debe a la inclusión de este elemento sobre su piel.
Wikimedia foundation. 2010.