- Sulfato de hierro (III)
-
Sulfato de hierro (III)
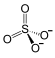 Fe3+
Fe3+  Fe3+
Fe3+ 
Nombre (IUPAC) sistemático Tetraoxosulfato (VI) de hierro (III) General Otros nombres Sulfato de hierro (III)
Sulfato férrico
Vitriolo de Marte
Pálido
Polvo sensible de humedad
Hygroskopisches
GeruclosasFórmula semidesarrollada Fe2(SO4)3 (forma anhidra)
Fe2(SO4)3·9H2O (nonahidrato)Fórmula molecular n/d Identificadores Número CAS 10028-22-5 (anhidro)
15244-10-7 (n-hidrato)
n=9, 7, 6, 4, 3, 1
Ver CAS de cada hidrato en [1]Propiedades físicas Estado de agregación Sólido Apariencia Blanco cristalino Densidad 1898 kg/m3; 1,898 g/cm3 Masa molar 399.87 (forma anhidra) g/mol Punto de fusión 753 K (480 °C) Estructura cristalina Rómbico Propiedades químicas Solubilidad en agua Soluble Compuestos relacionados Otros aniones Cloruro de hierro(III)
Óxido de hierro (III)
Bromuro de hierro (III)
Nitrato de hierro (III)Otros cationes Sulfato de hierro (II)
Sulfato de manganeso (III)
Sulfato de cobalto (III)
Sulfato de amonioTermoquímica ΔfH0sólido -2583,0 kJ/mol S0sólido 307,5 J·mol-1·K-1 Peligrosidad Frases R 22-36/37 Frases S 26 Riesgos Ingestión Nocivo leve. Baja toxicidad en bajas cantidades. Grandes dosis pueden causar dolor abdominal, náuseas, vómitos y diarrea; decoloración urinaria. Dosis muy altas: daño al hígado, Posible coma. Inhalación Irritaciones de las membranas mucosas y del tracto respiratorio. Tos. Dificultad respiratoria. Piel Irritaciones. Enrojecimiento y dolor. Ojos Irritaciones. Enrojecimiento y dolor. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referencias
El sulfato de hierro (III), sulfato férrico, Vitriolo de Marte, Pálido, geruclosas, hygroskopisches o polvo sensible de humedad es un compuesto de hierro, azufre y oxígeno. Se diferencia del más frecuente sulfato de hierro (II) en la carga del catión, siendo éste el estado más oxidado del átomo de hierro.Sal sólida de color amarillo, cristaliza en el sistema rómbico y es soluble en agua a temperatura ambiente.
Usos
- Se usa como mordiente antes de aplicar un colorante, y como coagulante para residuos industriales
- También se usa como pigmento colorante y en los baños de decapado para aluminio y acero.[1]
- Médicamente es usado como astringente y para lápiz estíptico.[2]
Obtención
Se produce a gran escala por reacción de ácido sulfúrico con una solución caliente de sulfato ferroso, usando un agente oxidante (como ácido nítrico o peróxido de hidrógeno).[3]
En las plantas de tratamiento de aguas residuales se usa como floculante para favorecer la sedimentación de partículas en los tanques de agua sin depurar.[4]
Referencias
- ↑ ferric sulfate. The Columbia Encyclopedia, 6ª Ed. Visto noviembre 2007.
- ↑ Ferric sulfate. Online medical dictionary. Visto noviembre 2007 (en inglés)
- ↑ Iron compounds, Art. Encyclopædia Britannica. Bajado noviembre 2007
- ↑ Spencer Hunt.Taming toxic waters. THE COLUMBUS DISPATCH.
Categorías:- Sulfatos
- Compuestos férricos
Wikimedia foundation. 2010.
