- Hexametilfosforamida
-
Hexametilfosforamida
Nombre (IUPAC) sistemático Hexametilfosforamida General Fórmula semidesarrollada C6H18N3OP Fórmula molecular n/d Identificadores Número CAS 680-31-9 Propiedades físicas Masa molar 179,20 g/mol Punto de fusión 280,4 K (7,25 °C) Punto de ebullición 508 K (234,85 °C) Propiedades químicas Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
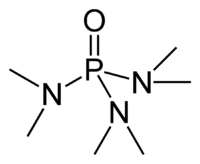
Exenciones y referenciasLa hexametilfosforamida, frecuentemente abreviada HMPA, es un compuesto organofosforado que tiene la fórmula [(CH3)2N]3PO. Este líquido incoloro es un solvente aprótico polar muy útil, y un aditivo en síntesis orgánica.
Contenido
Estructura y reactividad
HMPA es el óxido de la fosfina terciaria altamente básica hexametilfosforotriamida (HMPT), P(NMe2)3. Como otros óxidos de fosfina (por ejemplo, el óxido de trifenilfosfina), la molécula tiene un núcleo tetraédrico y un enlace P-O que está altamente polarizado, con una significativa carga negativa residiendo en el átomo de oxígeno.
Los compuestos que contienen un enlace nitrógeno-fósforo típicamente son degradados por el ácido clorhídrico para formar una amina protonada y fosfato.
Aplicaciones
HMPA es usado como solvente para polímeros, gases, y compuestos organometálicos. Mejora la selectividad de las reacciones de litiación, porque rompe los oligómeros de bases de litio, tales como el butillitio. Debido a que el HMPA solvata a los cationes, a la vez que no solvata aniones, acelera algunas reacciones SN2 difíciles. El átomo básico de oxígeno en HMPA se coordina fuertemente a Li+.[1] Un complejo de peróxido de molibdeno del HMPA es usado como oxidante en síntesis orgánica.
Reactivos alternativos
El dimetilsulfóxido puede ser usado frecuentemente en vez del HMPA como solvente. Ambos son fuertes aceptores de enlace de hidrógeno, y sus átomos de oxígeno se unen a cationes metálicos. Otras alternativas al HMPA incluyen la tetraalquilureas[2] y las alquilureas cíclicas como DMPU.[3]
Toxicidad
HMPA es sólo moderadamente tóxico, pero ha mostrado causar cáncer nasal en ratas.[1] HMPA puede ser degradado a compuestos menos tóxicos por acción del ácido clorhídrico.
Referencias
- ↑ a b Dykstra, R. R. "Hexamethylphosphoric Triamide" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons. doi 10.1002/047084289X.rh020
- ↑ Beck, A. K.; Seebach, D. "N,N'-Dimethylpropyleneurea" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, New York. doi 10.1002/047084289X.rd366.
- ↑ Triptikumar Mukhopadhyay, Dieter Seebach (1982). «Substitution of HMPT by the cyclic urea DMPU as a cosolvent for highly reactive nucleophiles and bases». Helvetica Chimica Acta 65 (1): pp. 385–391. doi:.
Enlaces externos
- The substance profile of HMPA in the report on carcinogens
- Merck Index, 12th Edition, 4761.
Categorías:- Solventes
- Carcinógenos
Wikimedia foundation. 2010.
