- Molibdeno
-
Niobio ← Molibdeno → Tecnecio Cr 
42Mo ↑
Mo
↓W Tabla completa • Tabla extendida Apariencia Gris metálico Información general Nombre, símbolo, número Molibdeno, Mo, 42 Serie química Metal de transición Grupo, período, bloque 6, 5, d Masa atómica 95,94 u Configuración electrónica [Kr]4d55s1 Dureza Mohs 5,5 Electrones por nivel 2, 8, 18, 13, 1 (imagen) Propiedades atómicas Radio medio 145 pm Electronegatividad 2,16 (Pauling) Radio atómico (calc) 190 pm (Radio de Bohr) Radio covalente 154 pm Estado(s) de oxidación 2,3,4,5,6 Óxido Ácido fuerte 1.ª Energía de ionización 684,3 kJ/mol 2.ª Energía de ionización 1560 kJ/mol 3.ª Energía de ionización 2618 kJ/mol 4.ª Energía de ionización 4480 kJ/mol Propiedades físicas Estado ordinario Sólido Densidad 10280 kg/m3 Punto de fusión 2896 K Punto de ebullición 4912 K Entalpía de vaporización 598 kJ/mol Entalpía de fusión 32 kJ/mol Presión de vapor 3,47 Pa a 3000 K Varios Estructura cristalina Cúbica centrada en el cuerpo N° CAS 7439-98-7 N° EINECS 231-107-2 Calor específico 250 J/(K·kg) Conductividad eléctrica 18,7·106 S/m Conductividad térmica 139 W/(K·m) Isótopos más estables iso AN Periodo MD Ed PD MeV 93Mo Sintético 4000 a ε 0,405 93Nb 99Mo Sintético 65,94 h β 1,357 99Tc 100Mo Sintético 1019 a β 3,034 100Ru 92Mo 14,84% Estable con 50 neutrones 94Mo 9,25% Estable con 52 neutrones 95Mo 15,92% Estable con 53 neutrones 96Mo 16,68% Estable con 54 neutrones 97Mo 9,55% Estable con 55 neutrones 98Mo 24,13% Estable con 56 neutrones 100Mo 9.63% Estable con 58 neutrones Nota: unidades según el SI y en CNPT, salvo indicación contraria. El molibdeno es un elemento químico de número atómico 42 que se encuentra en el grupo 6 de la tabla periódica de los elementos y se simboliza como Mo.[1]
El molibdeno es un metal esencial desde el punto de vista biológico y se utiliza sobre todo en aceros aleados.
Es es un metal plateado, tiene el sexto punto de fusión más alto de cualquier elemento. El molibdeno no se produce como el metal libre en la naturaleza, sino en varios estados de oxidación en los minerales. Industrialmente, los compuestos de molibdeno se emplean en aplicaciones de alta presión y alta temperatura, como pigmentos y catalizadores.
La mayoría de los compuestos de molibdeno tienen baja solubilidad en agua, pero el ion de molibdato MoO2-4 es soluble y se forma cuando los minerales que contienen molibdeno están en contacto con el oxígeno y el agua. Algunas teorías recientes sugieren que la liberación de oxígeno era importante en la eliminación de molibdeno de un mineral en una forma soluble en los océanos primitivos, donde se utiliza como catalizador de los organismos unicelulares. Esta secuencia puede haber sido importante en la historia de la vida, porque las enzimas que contienen molibdeno se convirtieron en los catalizadores más importantes utilizados por algunas bacterias para descomponerlos en átomos de nitrógeno. Esto, a su vez permitió al nitrógeno impulsar biológicamente la fertilización de los océanos, y por lo tanto el desarrollo de organismos más complejos.
Al menos 50 enzimas que contienen molibdeno son conocidas en bacterias y animales, aunque sólo las enzimas de bacterias y cyanobacterias están involucradas en la fijación de nitrógeno. Debido a las diversas funciones del resto de las enzimas, el molibdeno es un elemento necesario para la vida en organismos superiores, aunque no en todas las bacterias.
Contenido
Características principales
Propiedades físicas
El molibdeno es un metal de transición. Este metal puro es de color blanco plateado y muy duro; además, tiene uno de los puntos de fusión más altos de entre todos los elementos. En pequeñas cantidades, se emplea en distintas aleaciones de acero para endurecerlo o hacerlo más resistente a la corrosión. Por otra parte, el molibdeno es el único metal de la segunda serie de transición al que se le ha reconocido su esencialidad desde el punto de vista biológico; se encuentra en algunas enzimas con distintas funciones, concretamente en oxotransferasas (función de transferencia de electrones), como la xantina oxidasa, y en nitrogenasas (función de fijación de nitrógeno molecular).[2]
En su forma pura, como metal blanco plateado es el molibdeno con una dureza de Mohs de 5,5. Tiene un punto de fusión de 2.623 °C. De los elementos naturales, sólo el tantalio, el osmio, el renio, el wolframio y el carbono tienen puntos de fusión más alto.[3] El molibdeno sólo se quema a temperaturas superiores a 600 °C. Su coeficiente de dilatación es uno de los más bajos entre los metales utilizados comercialmente. Su resistencia a tracción hace que los cables de molibdeno aumenten de 10 a 30 GPa cuando disminuye su diámetro de 50-100 nm a 10 nm.[4]
Propiedades químicas
Estados de oxidación
del molibdeno.[5]−2 Na2[Mo2(CO)10] 0 Mo(CO)6 +1 Na[C6H6Mo] +2 MoCl2 +3 Na3[Mo(CN)]6 +4 MoS2 +5 MoCl5 +6 MoF6 El molibdeno es un metal de transición con una electronegatividad de 1,8 en la escala de Pauling y una masa atómica de 95,94 g/mol.[6] No reacciona con oxígeno o agua a temperatura ambiente. A temperaturas elevadas, se forma el óxido de molibdeno (VI):[7]
- 2 Mo + 3 O2 → 2 MoO3
El molibdeno tiene varios estados de oxidación (ver tabla). Un ejemplo es la inestabilidad del molibdeno (III) y del wolframio (III) en comparación con la estabilidad de cromo (III). El estado de oxidación es más común en el molibdeno (VI) (MoO3) mientras que el compuesto de óxido de azufre normal es el disulfuro de molibdeno (MoS2).[8]
El óxido de molibdeno (VI) es soluble en bases y contribuye en la formación de molibdatos (MoO42−). Los molibdatos son menos oxidantes que los cromatos, pero muestran una tendencia similar cuando forman oxoaniones complejos por condensación en los valores de pH más bajos, como [Mo7O24]6− y [Mo8O26]4−. Los polimolibdatos pueden incorporar otros iones en su estructura, formando polioxometalatos.[9] El fósforo que contiene heteropolimolibdato P[Mo12O40]3− se utiliza para la detección de espectroscopia en el fósforo.[10] La amplia gama de estados de oxidación del molibdeno se refleja en diversos cloruros de molibdeno:[8]
- Cloruro de molibdeno (II) MoCl2 (sólido de color amarillo)
- Cloruro de molibdeno (III) MoCl3 (sólido de color rojo oscuro)
- Cloruro de molibdeno (IV) MoCl4 (sólido de color negro)
- Cloruro de molibdeno (V) MoCl5 (sólido de color verde oscuro)
- Cloruro de molibdeno (VI) MoCl6 (sólido de color marrón)
La estructura del MoCl2 se compone de Mo6Cl84+ se compone de cuatro iones de cloruro que tienden a compensar la carga eléctrica.[8]
Como el cromo y algunos otros metales de transición, el molibdeno es capaz de formar enlaces cuádruples, como en Mo2(CH3COO)4. Este compuesto se puede transformar en Mo2Cl84− que también tiene un enlace cuádruple.[8]
El estado de oxidación 0 es posible con el monóxido de carbono como ligando, como en el molibdeno hexacarbonilo, Mo(CO)6.[8]
Aplicaciones
- Aproximadamente las dos terceras partes del molibdeno consumido se emplean en aleaciones. El uso del molibdeno se remonta a la Primera Guerra Mundial, cuando hubo una fuerte demanda de wolframio, que lo hizo escasear, y pico se necesitaban aceros muy resistentes.[11] [12] [1] El molibdeno se utiliza pues en aleaciones de alta resistencia y que soporten temperaturas y corrosiones sumamente altas. Estas aleaciones se usan en la construcción y en piezas de aviones y automóviles.[3] [13]
- El molibdeno se usa como catalizador en la industria petrolera. En concreto, es útil para la eliminación de azufre.
- El 99Mo se emplea en la industria de isótopos nucleares.[14]
- Se emplea en distintos pigmentos (con un color anaranjado), para pinturas, tintes, plásticos y compuestos de caucho.
- El disulfuro de molibdeno (MoS2) es un buen lubricante por sí mismo y brinda propiedades de tolerancia de presiones extremas a los lubricantes al reaccionar con el metal,[15] de manera que se forma una capa cristalina en la superficie de éste. Gracias a ello, el contacto metal-metal, destructivo a largo plazo, se reduce al mínimo y se puede emplear a altas temperaturas.[16] [12]
- El molibdeno se emplea en determinadas aplicaciones electrónicas, como en las capas de metal conductoras en los transistores TFT (Thin Film Transistor).[3]
Historia
El molibdeno no se encuentra libre en la naturaleza y los compuestos que se pueden encontrar fueron confundidos con otros compuestos de otros elementos (carbono o plomo) hasta el siglo XVIII.[11] En 1778 Carl Wilhelm Scheele hizo reaccionar el mineral molibdenita (MoS2) con ácido nítrico obteniendo un compuesto con propiedades ácidas al que llamó "acidum molibdenae" (la palabra molibdeno proviene del griego "molybdos" que quiere decir "como el plomo", puesto que era confundido con este elemento).[17] En 1782 Hjelm aisló el metal impuro mediante la reducción del anterior compuesto con carbono. El molibdeno se usó muy poco, y sólo dentro del laboratorio, hasta finales del siglo XIX, cuando una empresa lo utilizó como agente aleante y observó las buenas propiedades de estas aleaciones con molibdeno.[16] [18] [11] [19]
Durante mucho tiempo no había un uso industrial para el molibdeno. La compañía francesa Schneider Electric hizo la primera armadura de placas de acero de molibdeno en 1894. Hasta la Primera Guerra Mundial, la mayoría de las fábricas de armaduras también utilizan aleaciones de molibdeno. En la Primera Guerra Mundial, algunos tanques británicos estaban protegidos por 75 mm de planchas de manganeso, pero esto resultó ser ineficaz. Las placas de manganeso fueron sustituidas por 25 mm de planchas de molibdeno. Este cambio permitió más velocidad, y maniobrabilidad.[11] La alta demanda de molibdeno en las guerras mundiales y la fuerte disminución después de la guerra tuvo una gran influencia sobre los precios y la producción de molibdeno.
Abundancia y obtención
Molibdenita en cristal.
La principal fuente de molibdeno es el mineral molibdenita (MoS2). También se puede encontrar en otros minerales, como la wulfenita (PbMoO4) y la powellita (CaMoO4). El molibdeno se obtiene de la minería de sus minerales y como subproducto de la minería del cobre, siendo esta última el principal modo de explotación comercial; el molibdeno está presente en las minas en un rango de entre un 0.01 y un 0.5%. Aproximadamente la mitad de la producción mundial de molibdeno se localiza en Estados Unidos.
Los mayores productores del mundo de materiales de molibdeno son los Estados Unidos, China, Chile, Perú y Canadá.[11] [20] El molibdeno es un mineral extraído, y también se recupera como un subproducto de la extracción de cobre y wolframio. Las grandes explotaciones mineras en Colorado extraen molibdenita como su producto principal, mientras que muchos depósitos de pórfidos de cobre, como la mina Bingham Canyon en Utah y la mina de Chuquicamata, en el norte de Chile producen molibdeno como subproducto de la minería del cobre. La mina Knaben en el sur de Noruega se abrió en 1885, convirtiéndose en la primera mina de molibdeno. Se mantuvo abierta hasta 1973.[21] [22]
El molibdeno es el 54º elemento más abundante en la corteza terrestre y el 25º elemento más abundante en los océanos, con un promedio de 10 ppm.[3] [11] [23]
La molibdenita se calienta a una temperatura de 700 °C y el sulfuro se oxida en óxido de molibdeno (VI) por vía aérea:[8]
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
El mineral oxidado se calienta a 1.100 °C para sublimar el óxido, o crear lixiviados con el amoníaco, que reacciona con el óxido de molibdeno (VI) para formar molibdatos solubles en agua:
- MoO3 + 2 NH4OH → (NH4)2(MoO4) + H2O
La molibdenita de cobre, es menos soluble en amoniaco. Para eliminar completamente desde la solución, es precipitado con sulfuro de hidrógeno.[8]
El molibdeno puro es producido por la reducción del óxido de hidrógeno, mientras que el molibdeno que se usa para la producción de acero se reduce por la reacción aluminotérmica con la adición de hierro para producir ferromolibdeno. Una forma común de ferromolibdeno contiene 60% de molibdeno.[11] [8]
El molibdeno tiene un valor de aproximadamente $30.000 por tonelada en agosto de 2009. Se mantenía un precio en o cerca de $10.000 por tonelada entre 1997 y 2003, y alcanzó, debido al aumento de la demanda, un máximo de $103.000 por tonelada en junio de 2005.[24] En 2008, la Bolsa de Metales de Londres anunció que el molibdeno se negocia como un de los productos básicos en el intercambio.[25]
Papel biológico
Es el único elemento de la segunda serie de transición al que se le ha reconocido su esencialidad. El molibdeno se encuentra en la naturaleza en el rango de las partes por millón (ppm). Se encuentra en una cantidad importante en el agua de mar en forma de molibdatos (MoO42-), y los seres vivos pueden absorberlo fácilmente de esta forma.
El molibdeno se encuentra en el llamado cofactor de molibdeno (coMo) en distintas oxotransferasas, con la función de transferir átomos de oxígeno del agua (H2O) a la vez que se produce la transferencia de dos electrones. Algunas de las enzimas que contienen este cofactor son la xantina oxidasa (que oxida la xantina a ácido úrico), la aldehído oxidasa (que oxida los aldehídos, así como las aminas y los sulfuros en el hígado), la sulfito oxidasa (que oxida sulfitos en el hígado), y la nitrato reductasa (importante en el ciclo del nitrógeno en las plantas).[26]
Bioquímica
El molibdeno en los seres vivos es un heteroátomo de metal en el sitio activo en ciertas enzimas. En la fijación de nitrógeno en algunas bacterias, la enzima nitrogenasa participa en la etapa terminal de la reducción de nitrógeno molecular, por lo general contiene molibdeno en su sitio activo (aunque la sustitución de Mo con hierro o vanadio también es conocida). La estructura del centro catalítico de la enzima es similar a la de las proteínas hierro-azufre, que incorpora 2 moléculas (Fe4S3 y MoFe3S3).[2]
En 2008, se informó de que la escasez de molibdeno en los océanos de la Tierra primitiva era un factor limitante en la evolución de la vida de los seres eucariotas (que incluye todas las plantas y animales) como los eucariotas no pueden fijar el nitrógeno y debe adquirir de las bacterias procariotas.[27] [28] [29] La escasez de molibdeno da como resultado la relativa falta de oxígeno en el océano primitivo. El oxígeno disuelto en el mar ayuda a disolver los minerales de molibdeno en el fondo del mar. Sin embargo, aunque el oxígeno puede favorecer la fijación del nitrógeno a través de la toma de molibdeno disponible en el agua, también afecta a los venenos de estas enzimas nitrogenasas, por lo que los organismos que sigue para fijar el nitrógeno en condiciones aeróbicas están obligados a aislar a sus enzimas que fijan el nitrógeno en heterocistos, o estructuras similares.
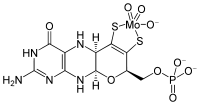 El cofactor de molibdeno contiene compuestos orgánicos de molibdopterina llamados complejos, que se une a un molibdeno a través del óxido de azufre.
El cofactor de molibdeno contiene compuestos orgánicos de molibdopterina llamados complejos, que se une a un molibdeno a través del óxido de azufre.
Los compuestos de molibdeno, tienen formas diversas moléculas orgánicas (como carbohidratos y aminoácidos) y se transporta a través del cuerpo humano como MoO42-.[30] Al menos 50 enzimas que contienen molibdeno son conocidos, principalmente en las bacterias, y su número aumenta con cada año;[31] [32] las enzimas incluyen la aldehído oxidasa, sulfito oxidasa y la xantina oxidasa.[11] En algunos animales y en humanos, se cataliza la oxidación de la xantina a ácido úrico, un proceso de catabolismo de las purinas, por la xantina oxidasa, una enzima que contiene molibdeno. La actividad de la xantina oxidasa es directamente proporcional a la cantidad de molibdeno en el cuerpo. Sin embargo, una alta concentración de molibdeno se invierte la tendencia y puede actuar como un inhibidor, tanto en el catabolismo de las purinas y otros procesos. Las concentraciones de molibdeno también afectan a la síntesis de proteínas, el metabolismo y el crecimiento.[30]
En los animales y las plantas, estas enzimas usan el molibdeno como un cofactor. Todos los seres vivos que utilizan enzimas de molibdeno hasta ahora identificadas en la naturaleza, usan este cofactor, salvo por la nitrogenasa, que fija el nitrógeno en algunas bacterias y cianobacterias.[33] Las enzimas de molibdeno en las plantas y animales catalizan la oxidación y la reducción a veces de ciertas moléculas pequeñas, como parte de la regulación de nitrógeno, azufre y los ciclos del carbono.[34]
Humanos con deficiencia alimentaria
El cuerpo humano contiene alrededor de 0,07 mg de molibdeno por kilogramo de peso.[35] Se presenta en altas concentraciones en el hígado y los riñones y en las vértebras.[3] El molibdeno también está presente en el esmalte de los dientes humanos y puede ayudar a prevenir su deterioro. La carne de cerdo, la carne de cordero y el hígado de res tienen cada uno alrededor de 1,5 ppm de molibdeno.[3] Otras fuentes alimenticias significativas son las judías verdes, huevos, semillas de girasol, harina de trigo, lentejas y granos de cereales.[11]
La ingestión diaria promedio de molibdeno varía entre 0,12 y 0,24 mg, pero depende del contenido de molibdeno de los alimentos.[36] La toxicidad aguda no se ha visto en los seres humanos, y depende en gran medida del estado químico.[37] [37] Aunque los datos de toxicidad humana no están disponibles, los estudios en animales han demostrado que la ingesta crónica de más de 10 mg/día de molibdeno puede causar diarrea, retraso en el crecimiento, infertilidad, y bajo peso al nacer.[36] [38] También puede afectar a los pulmones, los riñones y al hígado. El tungstato sódico es un inhibidor competitivo de molibdeno, y su dieta reduce la concentración de molibdeno en los tejidos.[3]
La deficiencia dietética de molibdeno desde su concentración bajo la superficie terrestre se ha asociado con mayores tasas de cáncer de esófago en partes de China e Irán.[39] [40] En comparación con Estados Unidos, que tiene una mayor oferta de molibdeno en el suelo, las personas que viven en estas áreas tienen un riesgo aproximadamente 16 veces mayor para el carcinoma esofágico de células escamosas.[41]
Enfermedades relacionadas
Un cofactor de molibdeno observado en los lactantes, termina con la capacidad del cuerpo para el uso del molibdeno en las enzimas. Hace que los altos niveles de sulfito y ácido úrico, y el daño neurológico.[42] [43] La causa es la incapacidad del cuerpo para sintetizar el cofactor de molibdeno, una molécula que se une con cadenas heterocíclicas de molibdeno en el sitio activo de todas las enzimas conocidas que utilizan el molibdeno.
Antagonismo del cobre
Los altos niveles de molibdeno pueden interferir con la absorción de cobre, produciendo deficiencia de cobre. El molibdeno evita las proteínas plasmáticas de unión al cobre, y también aumenta la cantidad de cobre que se excreta en la orina. Los rumiantes que consumen altas cantidades de molibdeno presentan síntomas como diarrea, pérdida de crecimiento, anemia y achromotrichia (pérdida del pigmento del cabello). Estos síntomas pueden ser aliviados por la administración de más cobre en el cuerpo, tanto en forma como por dieta y por inyección.[44] La condición puede ser agravada por el exceso de azufre.[3]
La reducción o la deficiencia de cobre también puede ser inducida deliberadamente con fines terapéuticos por el compuesto de amonio tetratiomolibdato, en la que el anión tetratiomolibdato brillante de color rojo es el agente "quelante" de cobre. El tetratiomolibdato fue utilizado por primera vez en el tratamiento de la toxicosis de cobre en los animales. Fue entonces cuando se introdujo como un tratamiento en la enfermedad de Wilson, un trastorno hereditario del metabolismo del cobre en los seres humanos, que actúa a la vez compitiendo con la absorción de cobre en el intestino y el aumento de la excreción. También se ha encontrado para tener un efecto inhibidor de la angiogénesis, posiblemente a través de la inhibición de iones de cobre, en el proceso de translocación de membrana participando una vía de secreción no clásica.[45] Esto hace que sea un tratamiento interesante de investigación para el cáncer, la degeneración macular asociada a la edad y otras enfermedades causan un depósito excesivo de molibdeno en los vasos sanguíneos.[46] [47]
Isótopos
El molibdeno tiene seis isótopos estables y cerca de dos docenas de radioisótopos, la mayor parte con periodos de semidesintegración del orden de segundos. El 99Mo se usa en los generadores de 99Mo/99mTc para la industria de isótopos nucleares. Se estima que este mercado de productos de 99Tc mueve unos 100 millones de euros al año. Estos generadores son muy usados para producir radiofármacos con tecnecio que se usan en medicina nuclear.
Se conocen 35 isótopos del molibdeno que van en masa atómica 83 a 117, así como cuatro isómeros nucleares. Siete isótopos se producen naturalmente, con las masas atómicas de 92, 94, 95, 96, 97, 98 y 100. De estos isótopos naturales, sólo el molibdeno-92 y el molibdeno-100 son inestables.[48] Todos los isótopos inestables se encuentran en los isótopos de molibdeno, niobio, tecnecio y rutenio.[49]
El molibdeno-98 es el isótopo más abundante, y representa el 24,14% del total de molibdeno. El molibdeno-100 tiene una vida media de alrededor de 1019 años y sufre una doble desintegración beta en el rutenio-100. Los isótopos de molibdeno con números de masa 111 a 117 tienen una vida media de aproximadamente 150 ns.[48] [49] [50]
Precauciones
El humo y el polvo del molibdeno pueden ser generados por la minería o la metalurgia, pueden ser tóxicos, especialmente si se ingieren. Los niveles bajos de exposición prolongados pueden causar irritación en los ojos y la piel. La inhalación o ingestión directa de molibdeno y sus óxidos se debe evitar.[51] [52] OSHA especifica la cantidad máxima admisible de exposición de molibdeno en una jornada de 8 horas de 5 mg/m³. La exposición crónica a 60 a 600 mg/m³ puede causar síntomas como fatiga, dolores de cabeza y dolores en las articulaciones.[53]
Referencias
- ↑ a b editor-in-chief David R. Lide. (1994). «Molybdenum». CRC Handbook of Chemistry and Physics. 4. Chemical Rubber Publishing Company. p. 18. ISBN 0849304741.
- ↑ a b Dos Santos, Patricia C.Patricia C.; Dean, Dennis R. (2008). «A newly discovered role for iron-sulfur clusters». PNAS 105 (33): p. 11589–11590. doi:. PMID 18697949.
- ↑ a b c d e f g h edited by Glenn D. Considine. (2005). «Molybdenum». escrito en New York. Van Nostrand's Encyclopedia of Chemistry. Wiley-Interscience. pp. 1038–1040. ISBN 9780471615255.
- ↑ «Inherent tensile strength of molybdenum nanocrystals» (free-download pdf). Science and Technology of Advanced Materials 10: pp. 045004. 2009. doi:.
- ↑ Schmidt, Max (1968). «VI. Nebengruppe» (en German). Anorganische Chemie II.. Wissenschaftsverlag. pp. 119–127.
- ↑ «Properties of Molybdenum». Integral Scientist Periodic Table. Qivx, Inc. (2003). Consultado el 10-06-2007.
- ↑ Winter, Mark. «Chemistry». Molybdenum. The University of Sheffield. Consultado el 10-06-2007.
- ↑ a b c d e f g h Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (91–100 edición). Walter de Gruyter. pp. 1096–1104. ISBN 3-11-007511-3.
- ↑ «Polyoxometalate Chemistry: An Old Field with New Dimensions in Several Disciplines». Angewandte Chemie International Edition 30: p. 34. 1997. doi:.
- ↑ ed. by Nollet, Leo M.L. (2000). escrito en New York, NY. Handbook of water analysis. Marcel Dekker. pp. 280–288. ISBN 9780824784331. http://books.google.com/books?id=YZpW4Y4Q_PIC&pg=PA280.
- ↑ a b c d e f g h i Emsley, John (2001). escrito en Oxford. Nature's Building Blocks. Oxford University Press. pp. 262–266. ISBN 0198503415. http://books.google.com/books?id=j-Xu07p3cKwC&pg=PA265.
- ↑ a b «Molybdenum». AZoM.com Pty. Limited (2007). Consultado el 06-05-2007.
- ↑ «Molybdenum Statistics and Information». U.S. Geological Survey (10-05-2007). Consultado el 10-05-2007.
- ↑ «Technetium-99m in clinical nuclear medicine». Annual review of medicine 20: pp. 131–40. 1969. doi:. PMID 4894500.
- ↑ Moulson, A. J.; Herbert, J. M. (2003). Electroceramics: materials, properties, applications. John Wiley and Sons. p. 141. ISBN 0471497487. http://books.google.com/books?id=FbMfaqSgOxsC&pg=PA141.
- ↑ a b Gagnon, Steve. «Molybdenum». Jefferson Science Associates, LLC. Consultado el 06-05-2007.
- ↑ Van der Krogt, Peter (10-01-2006). «Molybdenum». Elementymology & Elements Multidict. Consultado el 20-05-2007.
- ↑ Scheele, C. W. K. (1779). «Versuche mit Wasserbley;Molybdaena». Svenska vetensk. Academ. Handlingar 40: p. 238. http://resolver.sub.uni-goettingen.de/purl?PPN324352840_0040.
- ↑ Hjelm, P. J. (1788). «Versuche mit Molybdäna, und Reduction der selben Erde». Svenska vetensk. Academ. Handlingar 49: pp. 268. http://resolver.sub.uni-goettingen.de/purl?PPN324352840_0009_02_NS.
- ↑ Lide, David R., ed (2006). CRC Handbook of Chemistry and Physics. 4. Chemical Rubber Publishing Company. pp. 22–23. ISBN 0849304873.
- ↑ Coffman, Paul B. (1937). «The Rise of a New Metal: The Growth and Success of the Climax Molybdenum Company». The Journal of Business of the University of Chicago 10: p. 30. doi:.
- ↑ «Dispersion of tailings in the Knabena—Kvina drainage basin, Norway, 1: Evaluation of overbank sediments as sampling medium for regional geochemical mapping». Journal of Geochemical Exploration 58: p. 157. 1997. doi:.
- ↑ Jambor, J.L. et al. (2002). «New mineral names» (free download pdf). American Mineralogist 87: p. 181. http://www.minsocam.org/msa/AmMin/TOC/Abstracts/2002_Abstracts/Jan02_Abstracts/Jambor_p181_02.pdf.
- ↑ «Dynamic Prices and Charts for Molybdenum». InfoMine Inc. (2007). Consultado el 07-05-2007.
- ↑ «LME to launch minor metals contracts in H2 2009». London Metal Exchange (4 de septiembre de 2008). Consultado el 28 de julio de 2009.
- ↑ Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
- ↑ «Tracing the stepwise oxygenation of the Proterozoic ocean». Nature 452 (7186): pp. 456–460. 2008. doi:. PMID 18368114.
- ↑ «International team of scientists discover clue to delay of life on Earth». Eurekalert.org. Consultado el 25-10-2008.
- ↑ «Scientists uncover the source of an almost 2 billion year delay in animal evolution». Eurekalert.org. Consultado el 25-10-2008.
- ↑ a b Mitchell, Phillip C. H. (2003). «Overview of Environment Database». International Molybdenum Association. Consultado el 05-05-2007.
- ↑ Enemark, John H. et al. (2004). «Synthetic Analogues and Reaction Systems Relevant to the Molybdenum and Tungsten Oxotransferases». Chem. Rev. 104 (2): pp. 1175–1200. doi:. PMID 14871153.
- ↑ «Cell biology of molybdenum.». Biochimica et biophysica acta 1763 (7): pp. 621–635. 2006. doi:. PMID 16784786.
- ↑ [1] Structure, synthesis, empirical formula for the di-sulfhydryl. Accessed Nov. 16, 2009.
- ↑ «A structural comparison of molybdenum cofactor-containing enzymes». FEMS Microbiol. Rev. 22 (5): p. 503 pp. 503–521. 1999. doi:. PMID 9990727.
- ↑ Holleman, Arnold F.; Wiberg, Egon (2001). Inorganic chemistry. Academic Press. p. 1384. ISBN 0123526515. http://books.google.com/books?id=vEwj1WZKThEC&pg=PA1384.
- ↑ a b Coughlan, M. P. (1983). «The role of molybdenum in human biology». Journal of Inherited Metabolic Disease 6: pp. 70–77. doi:. PMID 6312191.
- ↑ a b «Risk Assessment Information System: Toxicity Summary for Molybdenum». Oak Ridge National Laboratory. Consultado el 23-04-2008.
- ↑ «Molybdenum». Clinical Toxicology 37 (2): pp. 231–237. 1999. doi:. PMID 10382558.
- ↑ Yang, Chung S. (1980). «Research on Esophageal Cancer in China: a Review». Cancer Research 40: p. 2633. http://cancerres.aacrjournals.org/cgi/reprint/40/8_Part_1/2633.pdf.
- ↑ Nouri, Mohsen; Chalian, Hamid; Bahman, Atiyeh; Mollahajian, Hamid; Ahmadi-Faghih, Mohammadamin; Fakheri, Hafez; Soroush, Ahmadreza (2008). «Nail Molybdenum and Zinc Contents in Populations with Low and Moderate Incidence of Esophageal Cancer». Archives of Iranian Medicine 11: p. 392. http://www.ams.ac.ir/AIM/08114/0010.pdf.
- ↑ «Prevention of Esophageal Cancer: The Nutrition Intervention Trials in Linxian, China». Cancer Research 54 (7 Suppl): pp. 2029s-2031s. 1994. PMID 8137333. http://www.nutritionhealthinfo.com/nutrition/nutrition_0163_001.pdf.
- ↑ Smolinsky, B. et al. (2008). «Splice-specific Functions of Gephyrin in Molybdenum Cofactor Biosynthesis» (free text). Journal of Biological Chemistry 283 (25): pp. 17370. doi:. PMID 18411266. http://www.jbc.org/content/283/25/17370.full.
- ↑ «Genetics of molybdenum cofactor deficiency». Human Genetics 106 (2): pp. 157. 2000. doi:. PMID 10746556.
- ↑ Suttle, N. F. (1974). «Recent studies of the copper-molybdenum antagonism». Proceedings of the Nutrition Society (CABI Publishing) 33 (3): pp. 299–305. doi:. PMID 4617883.
- ↑ Nickel, W (2003). «The Mystery of nonclassical protein secretion, a current view on cargo proteins and potential export routes». Eur. J. Biochem. 270: pp. 2109–2119. doi:.
- ↑ Brewer GJ, Hedera P, Kluin KJ et al. (2003). «Treatment of Wilson disease with ammonium tetrathiomolybdate: III. Initial therapy in a total of 55 neurologically affected patients and follow-up with zinc therapy». Arch Neurol 60 (3): pp. 379–85. doi:. PMID 12633149. http://archneur.ama-assn.org/cgi/content/full/60/3/379.
- ↑ A phase I trial of thiomolybdate as an chemotherapeutic agent in humans. Accessed Nov. 8 2009.
- ↑ a b Audi, Georges (2003). «The NUBASE Evaluation of Nuclear and Decay Properties». Nuclear Physics A (Atomic Mass Data Center) 729: pp. 3–128. doi:.
- ↑ a b editor-in-chief, David R. Lide. (2006). CRC Handbook of Chemistry and Physics. 11. CRC. pp. 87–88. ISBN 0849304873.
- ↑ Armstrong, John T. (2003). «Technetium». Chemical & Engineering News. Consultado el 07-07-2009.
- ↑ «Material Safety Data Sheet - Molybdenum». The REMBAR Company, Inc. (19-09-2000). Consultado el 13-05-2007.
- ↑ «Material Safety Data Sheet - Molybdenum Powder». CERAC, Inc. (23-02-1994). Consultado el 19-10-2007.
- ↑ «NIOSH Documentation for ILDHs Molybdenum». National Institute for Occupational Safety and Health (16-08-1996). Consultado el 31-05-2007.
Enlaces externos
Categorías:- Materiales superconductores
- Molibdeno
Wikimedia foundation. 2010.



