- Hidrólisis
-
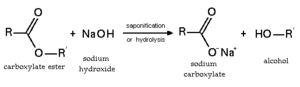 Hidrólisis de ésteres.
Hidrólisis de ésteres.
Se llama hidrólisis (del griego: ὕδωρ (hudōr), agua; y λύσις (lisis), pérdida o disociación) a una reacción ácido-base entre una sustancia, típicamente una sal, y el agua.[1] Esta reacción es importante por el gran número de contextos en los que el agua actúa como disolvente. También se aplica a algunas reacciones ácido-base en las que participa el agua y se rompe un enlace covalente, como se ilustra en la figura.
Al ser disueltos en agua, los iones constituyentes de una sal se combinan con los iones hidronio u oxonio, H3O+ o bien con los iones hidroxilo, OH-, o ambos. Dichos iones proceden de la disociación o autoprotólisis del agua. Esto produce un desplazamiento del equilibrio de disociación del agua y como consecuencia se modifica el valor del pH.


Los iones A-, BH+ procedentes de ácidos débiles AH o bases débiles B se hidrolizan por acción del agua, dependiendo el grado de la reacción de la debilidad del ácido o de la base; los iones procedentes de ácidos o bases fuertes no se hidrolizan apreciablemente. Tanto la reacción como su constante de equilibrio se pueden obtener por combinación de la reacción ácido-base con la reacción de autoprotólisis del agua. Así, las sales obtenidas a partir de ácidos y bases fuertes no se hidrolizan, las obtenidas a partir de ácidos y bases débiles se hidrolizan de forma que el pH depende de las dos constantes, y en las obtenidas a partir de una combinación de ácido y base en las que sólo uno es fuerte, será el fuerte el que determine el pH. EL ARCHIVO ESTA MAL, dado que si se utiliza cloruro de sodio (NaCl) al disociarse esta sal libera ion cloro, y este ion es más electronegativo que el oxígeno, provocando asi que el oxígeno NO se dirija al anodo. Para realizar de manera correcta la hidrólisis se necesita del ácido sulfúrico que al disociarse libera un ión menos electronegativo que el oxígeno, produciendo así que este último se diriga al anodo y poder comprobar asi la relacion 2:1 entre hidrógeno y oxígeno.
Referencias
Véase también
Categoría:- Reacciones químicas
Wikimedia foundation. 2010.
