- Disolvente
-
Un disolvente es una sustancia que permite la dispersión de otra sustancia en esta. Es el medio dispersante de la disolución. Normalmente, el disolvente establece el estado físico de la disolución, por lo que se dice que el disolvente es el componente de una disolución que está en el mismo estado físico que la misma. Usualmente, también es el componente que se encuentra en mayor proporción.
Los disolventes forman parte de múltiples aplicaciones: adhesivos, componentes en las pinturas, productos farmaceúticos, para la elaboración de materiales sintéticos, etc.
Las moléculas de disolvente ejercen su acción al interaccionar con las de soluto y rodearlas. Se conoce como solvatación. Solutos polares serán disueltos por disolventes polares al establecerse interacciones electrostáticas entre los dipolos. Los solutos apolares disuelven las sustancias apolares por interacciones entre dipolos inducidos.
El agua es habitualmente denominada el disolvente universal por la gran cantidad de sustancias sobre las que puede actuar como disolvente.
Contenido
Clasificación de los disolventes
- Disolventes polares: Son sustancias en cuyas moléculas la distribución de la nube electrónica es asimétrica; por lo tanto, la molécula presenta un polo positivo y otro negativo separados por una cierta distancia. Hay un dipolo permanente. El ejemplo clásico de solvente polar es el agua. Los alcoholes de baja masa molecular también pertenecen a este tipo. Los disolventes polares se pueden subdividir en:
- Disolventes polares próticos: contienen un enlace del O-H o del N-H. Agua (H-O-H), etanol (CH3-CH2-OH) y ácido acético (CH3-C(=O)OH) son disolventes polares próticos.
- Disolventes polares apróticos: son disolventes polares que no tiene enlaces O-H o N-H. Este tipo de disolvente que no dan ni aceptan protones. La acetona (CH3-C(=O)-CH3) y THF o Tetrahidrofurano son disolventes polares apróticos.
- Disolventes apolares: En general son sustancias de tipo orgánico y en cuyas moléculas la distribución de la nube electrónica es simétrica; por lo tanto, estas sustancias carecen de polo positivo y negativo en sus moléculas. No pueden considerarse dipolos permanentes. Esto no implica que algunos de sus enlaces sean polares. Todo dependerá de la geometría de sus moléculas. Si los momentos dipolares individuales de sus enlaces están compensados, la molécula será, en conjunto, apolar. Algunos disolventes de este tipo son: el dietiléter, cloroformo, benceno, tolueno, xileno, cetonas, hexano, ciclohexano, tetracloruro de carbono es el que disuelve o va a disolver, o también el diablo rojo, etc. Un caso especial lo constituyen los líquidos fluorosos, que se comportan como disolventes más apolares que los disolventes orgánicos convencionales.
Disolventes orgánicos
Véase también: Compuestos orgánicos volátilesLos disolventes más utilizados actualmente, son los disolventes orgánicos, que son compuestos orgánicos volátiles que se utilizan solos o en combinación con otros agentes, sin sufrir ningún cambio químico, para disolver materias primas, productos o materiales residuales, o se utilice como agente de limpieza para disolver la suciedad, o como disolvente, o como medio de dispersión, o como modificador de la viscosidad, o como agente tenso-activo,paparaipicoipiEl uso de estos disolventes, libera a la atmósfera compuestos orgánicos volátiles (COVs), que tienen algunos problemas importantes para el entorno. Algunos COVs causan la degradación de la capa de ozono como es el caso de 1,1,1-tricloroetano, tetracloruro de carbono, CFCs, HCFCs.
El carácter volátil de los disolventes orgánicos hace que éstos se evaporen rápidamente en el aire, alcanzando concentraciones importantes en espacios confinados. Los riesgos mayores para el ser humano se producen por la absorción de éstos a través de la piel y por inhalación. El contacto directo con la piel permite que el disolvente pase a la sangre, causando efectos inmediatos y a más largo plazo.
Para reducir el impacto medioambiental de los actuales disolventes orgánicos existen una serie de sustancias que se pueden usar como alternativas, siendo los llamados disolventes alternativos o nuevos disolventes, pertenecientes a la rama de la Química verde, en la que se pueden englobar los siguientes principios:
- El diseño de procesos que incorporen al máximo en el producto final todos los materiales usados durante el proceso, minimizando la obtención de subproductos.
- El uso de sustancias seguras y respetuosas con el medio ambiente como son los disolventes reactivos, etc.
- El diseño de procesos enérgicamente eficientes.
Clases de disolventes alternativos
- Disolventes reactivos: Son disolventes con baja volatilidad relativa, y tienen la capacidad de reaccionar con otros componentes, evaporándose al medioambiente (no constituyen COV´s).
- Disolventes benignos: Son aquellos disolventes ambientalmente respetuosos. En este grupo se hallan los disolventes libres de compuestos clorados, con baja toxicidad y baja reactividad incremental máxima, comparados con los disolventes convencionales.
- Disolventes neotéricos: Como su propio nombre indica, del término neo significa moderno, contemporáneo, reciente. Son una serie de disolventes que presentan una menor toxicidad, son más seguros y menos contaminantes que los disolventes convencionales . Entre ellos se incluyen tanto nuevos fluidos con propiedades ajustables, como compuestos poco usados como disolventes en la actualidad. Pero que están siendo investigados por sus usos potenciales como disolventes, ya que permitirían una mayor sostenibilidad en futuras aplicaciones. Éste es el caso del dióxido de carbono supercrítico (scCO2), y el líquido iónico a temperatura ambiente.
Clasificación de los disolventes neotéricos
- Agua
- Líquido fluoroso
- Líquido iónico
- Fluido supercrítico
El agua empleada como disolvente
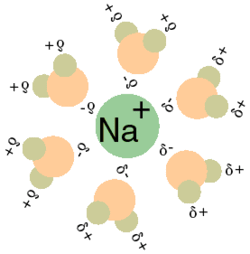
El agua, denominado como el disolvente universal, es la mejor elección como disolvente, desde un punto de vista medioambiental, ya que no es ni inflamable, ni tóxica. Aunque presenta el inconveniente de tener una baja solubilidad con las resinas. El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ion es soluble en agua si puede interactuar con las moléculas de la misma mediante puentes de hidrógeno o interacciones del tipo ion-dipolo. Solubilidad de iones en agua con aniones que tengan átomos de oxígeno, pueden formar puentes de hidrógeno, dado que el oxígeno actúa como aceptor de los mismos. Además, hay que tener en cuenta la atracción del anión sobre el dipolo del agua. Lo mismo ocurre con Cl- o F-, que tienen pares de electrones solitarios y que pueden actuar como aceptores de puentes de hidrógeno. Por su parte, los cationes como el Na+, el K+, el Ca++ o el Mg++ se rodean de moléculas de agua a las que unen mediante interacciones del tipo ion-dipolo; los átomos de oxígeno se orientan hacia el catión.
Conforme aumenta la temperatura y la presión, las propiedades del agua varían. Por ejemplo, la constante dieléctrica disminuye y se hace más similar a la de los disolventes orgánicos, mejorando la solubilización de sustancias iónicas. A alta temperatura y presión disuelve compuestos orgánicos, transcurriendo los procesos en fase homogénea y con ello se facilita la separación del soluto (por enfriamiento), siendo capaz de eliminar residuos.
Líquido fluoroso
El término fluoroso fue introducido por István T. Horvát en la década de 1990 por su analogía con los medios acuosos. Son compuestos orgánicos en los que se han sustituido los enlaces carbono-hidrógeno por carbono-flúor y que se encuentra en estado líquido en condiciones normales.
- Son químicamente inertes, por lo que se evita la obtención de subproductos.
- Son térmicamente estables, por lo que se pueden usar a altas temperaturas sin peligro.
- No son inflamables ni tóxicos, por lo que se evita los riesgos de incendios o explosiones.
- Se pueden mezclar con muchos disolventes orgánicos y con el agua, lo que facilita el uso de sistemas bifásicos.
- Poseen un amplio intervalo de puntos de ebullición. (de 50 a 220º)
Líquido iónico
Son compuestos que presentan características de sales con su punto de temperatura de fusión por debajo de los 100ºC. Compuestos por un catión orgánico siendo uno de los mas comunes el tetraalquilamonio, y un aniónpoliatómico como puede ser el hexafluorofosfato. Los líquidos iónicos pueden ser constituidos por un gran número de aniones y cationes con lo que sus propiedades varían de unos a otros. En cuanto a la utilización de un líquido iónico como disolvente alternativo, reseñar que presenta una escasa volatilidad, debido a su presión de vapor prácticamente nula. También presenta una excelente estabilidad química y térmica, pudiéndose emplear a elevadas temperaturas.Y una gran solvatación con otras muchas sustancias. En contra partida decir que su coste de obtención es elevado.
Fluido supercrítico
Por su importancia como disolvente alternativo cabe destacar el fluido supercrítico, que es aquel que se encuentra por encima de su presión y de su temperatura crítica. En este estado, la línea de separación de fases líquido-gas se interrumpe. Esto implica la formación de una sola fase, en la que el fluido tiene propiedades intermedias entre las de un líquido y las de un gas, por lo que mientras se mantiene una gran difusividad propia de los gases, se consigue una alta densidad cercana a la de los líquidos.
Considerados como inertes y no tóxicos, siendo su coste barato y pudiendo variar sus propiedades con cambios de presión. La propiedad más característica de los fluidos supercríticos es el amplio rango de altas densidades que pueden adoptar dependiendo de las condiciones de presión o de temperatura, a diferencia de los líquidos que son prácticamente incompresibles, y de los gases que poseen densidades siempre muy bajas.
Aplicaciones
- En la producción de principios activos farmacéuticos
- En la producción de biodiésel y utilización de subproductos
- En la producción de protectores de cosechas
- En barnices y pinturas, etc.
Ventajas
Los disolventes neotéricos se pueden obtener a partir de materias primas renovables, siendo una alternativas a los disolventes derivados del petróleo. Siendo un ejemplo de ellos,los procedentes de la biomasa.
La mayoría de estos disolventes presentan una baja toxicidad, baja volatilidad, no son corrosivos, ni cancerígenos. Además muchos de ellos se obtienen a partir de residuos vegetales, lo que les hace económicamente competitivos.
Disolvente sostenible
Un disolvente sostenible es aquel que es inocuo para el medio ambiente.
Conclusiones
Los disolventes neotéricos o alternativos son compuestos con los que se pretende sustituir a los ya conocidos como disolventes convencionales en su uso industrial , por su importancia en la protección medioambiental, debido a su posibilidad de reutilización, reciclado y su baja o nula toxicidad.
La Unión Europea estima que en la Comunidad se emiten cada año alrededor de 10 millones de toneladas de compuestos orgánicos volátiles procedentes de los carburantes y disolventes. En marzo de 1.999 se aprobó la Directiva (99/13) relativa a la “limitación de las emisiones de compuestos orgánicos volátiles debidas al uso de disolventes orgánicos en determinadas actividades e instalaciones”. En esta directiva se prevé reducir en dos tercios el uso de compuestos orgánicos volátiles liberados en la atmósfera por el uso de disolventes industriales. Una forma de reducir este uso de compuestos es el empleo de los disolventes neotéricos.
La importancia del desarrollo de estos disolventes radica primordialmente en su coste, puesto que al ser económicamente rentables, hace viable su implementación en los procesos industriales.
Referencias bibliográficas
- Disolventes y métodos de reacción no convencionales. (Master en Química Sostenible año 2008-2009 de la Universidad de Zaragoza)
- Desarrollo de nuevos procesos biotecnológicos basados en el uso de líquidos iónicos, fluidos supercríticos y tecnología de membranas. (Memoria por Francisco José Hernández Fernández, Universidad de Murcia año 2008)
- Mayoral, J.A.; “Empleo de disolventes alternativos”, publicación en Internet: www.unia.es/ nuevo_inf_academica/ bisualizar_file_adjunto.asp? ID = 1606.
- Restrepo, J.A. "Disolventes Alternativos". Inpra Latina; (Edición digital Vol.13 Nº5 Septiembre/Octubre 2008, pág.16-19)
Referencias
Véase también
- Disolución
- Disolvente sostenible
- Química verde
- 2-Metiltetrahidrofurano
- Lactato de 2-etilhexilo
- Estasol
- Solubilidad
- Concentración
- Liposoluble
- Hidrosoluble
Enlaces externos
- UNIZAR Master de Química Sostenible
- Disolventes y métodos de reacción no convencianales
- Portal para las industrias de pinturas y recubrimientos
- Departamento de Medio Ambiente del Gobierno Vasco
- Tecnologías de Fluídos Comprimidos
- Solventes alternativos, fluídos supercríticos en portugúes
- Los fluídos supercríticos como disolventes alternativos
- Disolventes mas seguros
- Desarrollo de nuevos procesos biotecnológicos
- El agua como disolvente
- Disolventes polares: Son sustancias en cuyas moléculas la distribución de la nube electrónica es asimétrica; por lo tanto, la molécula presenta un polo positivo y otro negativo separados por una cierta distancia. Hay un dipolo permanente. El ejemplo clásico de solvente polar es el agua. Los alcoholes de baja masa molecular también pertenecen a este tipo. Los disolventes polares se pueden subdividir en:
Wikimedia foundation. 2010.