- Microcycas calocoma
-
Palma corcho

Jardín en el pueblo de Viñales, Pinar del Río, CubaEstado de conservación 
En peligro crítico (UICN)Clasificación científica Reino: Plantae Subreino: Tracheobionta Subdivisión: Cycadophytina Clase: Cycadopsida Orden: Cycadales Familia: Zamiaceae Subfamilia: Zamioideae Tribu: Zamieae Subtribu: Microcycadinae Género: Microcycas Especie: M. calocoma Nombre binomial Microcycas calocoma
(Miq.) A.DC.Microcycas calocoma (Miq.) A.DC es una cícada de la familia Zamiaceae, endémica de Cuba y única de su género. Tiene apariencia de palma, y al igual que todos los miembros de este orden es una especie dioica.
Contenido
Microcycas calocoma (Miq.) A.DC Historia de denominaciones
El holandés Frederich A.W. Miquel describió la especie en 1851, como Zamia calocoma y la incluyó en la nueva sección Microcycas. Este último nombre es debido a que el pequeño ejemplar cultivado que describió le recordaba el aspecto de un pequeño Cycas revoluta. Su nombre específico calocoma le viene del griego calo- hermosa y coma- cabellera, es decir hermosa corona de hojas.
Luego, en 1868, el suizo Alphonse De Candolle estableció la diferenciación de la especie como género Microcycas, al describir ejemplares de herbario que tenían estructuras reproductoras. El nombre genérico resulta desafortunado para una especie que es más cercana a Zamia y que es una de las más altas de Cycadales.
Su porte arbóreo fue descrito por primera vez en 1907 por los norteamericanos Otis W. Caldwell y C. F. Baker a partir de observaciones de campo.
Su nombre común es corcho o palma corcho. Se le han atribuido distintos orígenes al nombre común: debido al aspecto de las semillas, o a la fragilidad del tronco. Sin embargo, el cubanismo corcho significa un tronco hueco con colmena. (Caldwell & Baker, 1907; Caldwell 1907; Cendrero, 1940; García-Pelayo y Gross,. 1977)
Distribución
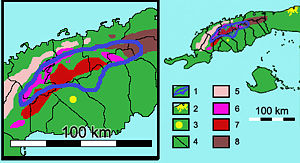 Mapa de distribución.
Mapa de distribución.
Los cuadros de leyenda corresponden a: 1- Área de distribución de Microcycas calocoma (bordeada en azul). 2- Ciudad de La Habana. 3- Ciudad de Pinar del Río. 4- Límites municipales de la provincia Pinar del Río. 5 a 8- Sistemas montañosos (5- Alturas Pizarrosas del Norte, 6- Sierra de Los Órganos, 7- Alturas Pizarrosas del Sur, y 8- Sierra del Rosario). Según Risco et al. (1984) y Peña et al. (1998).La especie es exclusiva de la provincia de Pinar del Río en Cuba occidental. Existe naturalmente en 8 municipios: San Cristóbal , Bahía Honda, Los Palacios, La Palma, Consolación del Sur, Viñales, Pinar del Río y Minas de Matahambre (CNCP, 2007).
Su área de distribución se encuentra en el centro-norte de la provincia, aproximadamente entre las longitudes 83º15’- 84º00’W y las latitudes 22º21’-22º47’N. Esta área se extiende en menos de 2000 km², en una franja de unos 90 km de largo y está formada por numerosas colonias aisladas. Éstas pueden tener desde unos pocos hasta 150 individuos, y sumadas ocupan una superficie estimada en menos de 10 km². Esta área abarca parte de la Cordillera de Guaniguanico, en tres de sus grupos orogénicos: Sierra de los Órganos, Sierra del Rosario y Alturas Pizarrosas del Sur; y también ocupa partes altas de la Llanura Aluvial del Sur. Esto hace que su área pueda diferenciarse en cuatro paisajes o regiones al estar presente en cuatro distritos fitogeográficos cubanos: Viñalense, Rosariense, Pinarense y Sabaloense donde forman parte de cuatro formaciones vegetales cubanas: complejo de vegetación de mogotes, Bosques semideciduos, Pinares y relictos de bosques en galería. Cada región se caracteriza por sus tipos de suelos. Éstos pueden ser derivados de esquistos, pizarras y calizas, con estratificaciones mixtas o no, pueden ser desde cárstico-esqueléticos hasta profundos, con textura pedregosa, gravillosa, arenosa-limosa o arcillosa, ser desde alcalinos (calizos) hasta ácidos (silíceos), y a menudo son superficialmente ricos en materia orgánica.
Las altitudes sobre el nivel del mar donde se encuentran van desde algunas decenas de metros al borde de arroyos en la Llanura Aluvial del Sur, hasta 665 msnm en la Sierra del Rosario.
En la naturaleza abundan más en lugares rocosos o de pendiente elevada, con bosques bajos de dosel abierto que les permitan insolación media. En lugares así compiten mejor por la luz sin resultar demasiado secos para la supervivencia de plántulas. Sin embargo en cultivo las plantas se desarrollan mejor a pleno sol o con poca sombra, en suelos fértiles y bien drenados. (Caldwell, 1909; Cendrero, 1940; Foster & Rodríguez San Pedro, 1942; Mercado, 1977; Risco et al. 1984; Capote & Berazaín,1984; Osborne & Milanés Santana, 1995; Borhidi, 1996; Peña et al., 1988; Peña et al., 1997a; Peña et al., 1998; CNCP, 2007)
Caracteres
Tronco. La planta alcanza tamaño arbóreo, excepcionalmente hasta 11 m de altura en los lugares resguardados de fuertes vientos. Las plantas típicas son de tronco no ramificado. A medida que envejecen es más frecuente encontrarlas con dos o más ramificaciones en respuesta a rupturas del tronco o a daño de la yema apical. El tronco íntegro tiene forma de sección de cono muy alargado y el diámetro a la altura del pecho va de cerca de 1 dm en ejemplares jóvenes a cerca de 4 dm en los viejos más altos. Los ejemplares dañados aún más viejos pueden alcanzar hasta 7 dm de diámetro. Algunas plantas, en lugares muy húmedos, pueden conservar en toda su extensión las bases de hojas y catáfilos formando una armadura a modo de coraza, pero normalmente el tronco queda libre de ellas, mostrando una corteza grisácea con engrosamientos en anillos que son los sitios donde se portaban las coronas de hojas. Algunas veces en la porción más baja, la corteza puede crecer hasta desvanecer los anillos y presentar agrietamientos similares a los de un pino. La planta joven en la naturaleza demora muchos años desarrollando un tronco subterráneo que puede alcanzar hasta 95 mm de diámetro antes de desarrollar un tronco aéreo. (Caldwel & Baker, 1907; Caldwell, 1907; Caldwell, 1909; Cendrero, 1940; Foster & Rodríguez San Pedro, 1942).
Hojas. Son pinnadas de color verde claro cuando nuevas y verde oscuro las ya maduras, rectas o ligeramente arqueadas, de 60 a 100 cm × 20 a 25 cm . En número pueden ser desde unas pocas hasta 50. Son producidas simultáneamente y distribuidas al mismo nivel u organizadas en series espirales de varios niveles. Forman una corona o cúpula graciosa redondeada, de apariencia pequeña respecto a otras cícadas de similar altura (Caldwell, 1909; González Géigel, 2003). Peciolo: es de cerca de 1 dm de largo, sin espinas, cilíndrico, con base ensanchada en forma de escudo (Caldwell, 1909). Raquis: es semicilíndrico, sin espinas, persiste colgante después de la caída de los foliolos hasta 5 años (Caldwell, 1909; González Géigel, 2003). Foliolos: son de 8-25 cm × 0,5-1,5 cm; brillantes en el haz, coriáceos, flexibles, con 15-20 venas bifurcadas que se reducen a 6-8 el ápice, no hay nervadura central. Son de margen entero y ligeramente revoluto, linear-lanceolados, ligeramente reflexos (o ligeramente falcados), base estrechada, ápice agudo. Los foliolos son opuestos o casi, distribuidos regularmente y poco distanciados, hasta 160 por hoja, están articulados al raquis de forma deflexa, es decir que apuntan ligeramente hacia abajo dándoles apariencia colgante, formando una V invertida abierta en visión transversa de la hoja. Los foliolos son de longitud casi homogénea a todo lo largo del raquis, lo que da a la hoja apariencia de haber sido cortada en su extremo. Los foliolos duran hasta 3 años y se desprenden al secarse dejando una cicatriz oval de 4-5 cm en el raquis. (Caldwell, 1909; Jones, 1993; González Géigel, 2003).
Catáfilos. Son como hojas escamosas que protegen la yema apical, producidos en periodos alternados con las verdaderas hojas. Son triangulares, de 4 a 12 cm × 1,5 a 2 cm; a menudo con la punta torcida, densamente tomentosos con pelos largos grises salvo en la base del haz (Caldwell & Baker, 1907; Caldwell, 1909; González Géigel, 2003).
Cono o estróbilo masculino. Uno por ápice, rara vez un segundo pero un mes después. Casi cilíndrico o cónico-cilíndrico, puede tener de 20-54 cm × 8-12 cm de diámetro, pedúnculo de 2-8 cm y región de esporofilos de 18-46 cm de largo con 11-13 series espirales con hasta 65 esporofilos. En cultivo los conos pueden llegar a 1 m de largo (Osborne & Milanés Santana, 1995; Peña et al., 1997b; González Géigel, 2003). Esporofilos masculinos (o microsporofilos): de 1,2-2,5 cm × 1-2 cm; tienen la cara externa parda clara, pubescente, muy prominente, alta de 6 a 7 mm . Los microsporangios son esféricos, de 1,5 mm de diámetro. Las microsporas o polen son de 50 - 60 μm de diámetro, esféricas, producidas muy abundantemente (González Géigel, 2003).
Cono o estróbilo femenino. Casi cilíndrico o cónico-cilíndrico, ápice obtuso, puede tener de 3-7 dm de largo y el diámetro de 13-16 cm, pedúnculo 2-4 cm de largo Un cono ya polinizado puede llegar hasta 94 cm de largo y 9,5 kg como caso extremo fuera del promedio en la naturaleza (Caldwell & Baker, 1907; Caldwell, 1909; González Géigel, 2003). Esporofilos femeninos (o megasporofilos): de 4,5-5,5 cm de largo, con peciolo de 3-3,5 cm de largo, y su cara externa muy prominente; 1,5-2 cm × 3-4 cm y alta 2-3 cm, pubescente con pelos grisaceos, con cuatro o seis aristas, casi piramidal, el ápice truncado, usualmente con cuatro lóbulos basiscópicos y con dos óvulos ([megasporangios]) sésiles en la cara interna. A nivel microscópico, los arquegonios, órganos sexuales femeninos del megagametofito, son numerosísimos, llegando a veces a más de 200, comparados con uno a cerca de seis que se presentan en otras cícadas. Éstos se distribuyen como es normal cerca del micrópilo, pero además se encuentran en menor número en los lados y hasta en el extremo basal del megagametofito. Éstos atípicamente ubicados son infuncionales por resultar inaccesibles para los espermatozoides. También microscópicamente, en los microgametofitos (desarrollados dentro del megasporangio polinizado), el tubo polínico produce de ocho a dieciséis espermatozoides, en vez de dos, cantidad típica en cicadales. (Caldwell, 1909; Norstog, 1990; Jones, 1993). Los megasporangios se convierten en semillas de 2,5-4 cm × 1-2,5 cm, con sarcotesta de grosor de hasta 4 mm, al madurar pasa de color rosado a rojo esclerotesta fina, de 1 mm , dura, lisa y de color pardo (Caldwell & Baker, 1907; Caldwell, 1909; Jones, 1993; González Géigel, 2003).
Raíces. La raíz principal puede extenderse verticalmente cerca de un metro si el suelo es profundo. Si el suelo es pedregoso las raíces se extienden entre las rocas sin raíz vertical aparente (Caldwell, 1909). Cuando existen daños en el tronco, pueden surgir raíces aéreas que se extienden hacia el suelo (Foster & Rodríguez San Pedro, 1942). Además, igual que las otros cicadales, Microcycas produce raíces coraloides en raíces laterales con geotropismo negativo. Éstas son raíces nodulosas parecidas a corales resultantes de una ramificación dicotómica frecuente. Se desarrollan como típicas coraloides cuando albergan algas cianofíceas simbióticas. Pueden concurrir varias especies simultáneas de algas del género Nostoc o también, a veces, Anabaena, que se reproducen extracelularmente en una capa cortical que adquiere coloración verde. Si las raíces coraloides no son invadidas por algas, no progresan al desarrollo típico y mueren pronto. Pero si son invadidas por bacterias azotobacteriáceas del género Beijerinckia que viven intracelularmente en células de la corteza externa, entonces estos nódulos atípicos de coloración rosada perduran. Se supone que en su origen las raíces coraloides funcionan como neumatóforos, y que después de su colonización se transforman en órganos fijadores de nitrógeno atmosférico (Mercado, 1977).
Número cromosómico: 2n = 26 (2 centromérico medios +2 submedios + 2 subterminales + 20 terminales) (Kokubugata et al., 1998).
Relaciones filogenéticas cercanas
Los análisis cladísticos de datos morfológicos, anatómicos, cariológicos, fisiológicos y fitoquímicos sitúan a Microcycas (subtribu Microcycadinae) como rama hermana de Zamia y Chigua (subtribu Zamiinae), y ambas son incluidas en la tribu Zamieae de la que es hermana Ceratozamia (tribu Ceratozamieae) (Stevenson, 1992). Según estudios filogenéticos basados en polimorfismos de ADN se confirma la relación de Microcycas muy cercana con Zamia, a las que a su vez también les encuentran relación cercana con Ceratozamia y Stangeria (Chaw et al., 2005).
Reproducción
Los primeros conos comienzan a crecer en mayo o en junio -julio si el clima no es propicio. Están desarrollados y se abren entre agosto y octubre. En las plantas femeninas son receptivos en un periodo es algo más reducido sobre septiembre cuando pueden ser polinizados. La receptividad del cono femenino se reconoce cuando se produce una abertura vertical entre los esporofilos. Los conos masculinos se marchitan tras la liberación del polen y los femeninos permanecen cerca de 10 meses, hasta mayo- julio tanto si maduran las semillas como si no han sido fecundados. (Cendrero, 1940; Foster & Rodríguez San Pedro, 1942; Osborne & Milanés Santana, 1995; Peña et al., 1997b).
Se considera que la reproducción de Microcycas ocurre por medio de la polinización de insectos mutualistas obligados, al igual que en la mayoría de los géneros de cícadas, o probablemente en todos. Los insectos polinizadores de cícadas son atraídos por el fuerte olor de los conos masculinos de estas plantas, donde ellos se reproducen y consumen el muy abundante polen. Sus larvas se alimentan igualmente de polen o de tejidos internos. Estos insectos también son atraídos por los mismos olores presentes en los conos femeninos que así los confunden obligándolos a polinizarlos mientras buscan en vano alimento o sitio para depositar sus huevos. Se ha supuesto que el polinizador mutualita de Microcycas está muy disminuido y hasta extirpado en muchas localidades ya que en ellas es baja la reproducción natural o no hay ninguna.
En 2005 se describió un escarabajo pequeño (aproximadamente de 4 mm de largo), Pharaxonotha esperanzae Chaves & Genaro (Erotylidae, Coleoptera), que ha sido implicado como probable polinizador de Microcycas en áreas bien conservadas. Otras especies de Pharaxonotha también son polinizadoras de zamiáceas del Nuevo Mundo. El descubrimiento de este insecto brinda esperanzas de que pueda incrementarse en cautiverio y restablecerse en localidades para restaurar la reproducción de Microcycas donde está ausente. (Vovides et al., 1997; Donaldson, 2003; Chaves & Genaro, 2005)
Los dispersores de semillas de Microcycas no han sido aún identificados y pueden estar implicados como un factor de riesgo para su conservación al afectar la implantación y supervivencia de las plántulas. Los planes de conservación in situ de cícadas necesitan asegurar la existencia continuada de interacciones claves con los simbiontes de raíces, los polinizadores, y las especies dispersoras de semillas (Peña et al. 1997a; Donaldson, 2003).
Conservación in situ
Microcycas calocoma es una especie emblemática de la flora en Cuba, donde fue declarada en 1989 Monumento Natural Nacional, única especie así distinguida, con protección legal especial (Correoso, 1989). Hasta mediados del siglo XX sólo se conocían reportes de las localidades más accesibles de la mitad oriental del área de distribución (Caldwell, 1907 y 1909; Chamberlain, 1919; Cendrero, 1940; Foster & Rodríguez San Pedro, 1942), que en su mayoría, eran también las más perturbadas por encontrarse en áreas aptas para la explotación agrícola y ganadera, que estaban deforestadas, sufrían quemas y el consumo de semillas por cerdos (Risco et al., 1984; Peña et al., 1988). Ya entonces era consideraba una especie muy rara, en peligro de extinguirse, principalmente por el bajo número de ejemplares conocidos y las limitaciones observadas en su reproducción (Foster & Rodríguez San Pedro, 1942).
Trabajos de exploración y monitoreo desde la década de 1980 han descubierto otras localidades bien conservadas y con reproducción natural anual, que están protegidas en dos reservas del Sistema Nacional de Áreas Protegidas de Cuba: Parque Nacional de Viñales y Área Protegida de Recursos Manejados Mil Cumbres (Risco et al., 1984; Peña et al., 1988; Peña et al., 1997a; Peña et al., 1998; Lazcano, 2005). Hasta 1998 se contabilizaban 23 localidades de Microcycas, con una estimación de 800 a 1000 plantas (Peña et al., 1998). Una referencia de 2004 reporta la visita a 69 colonias con 6188 ejemplares en los mogotes de la Sierra de los Órganos (Carmenate, 2004), que es la región mejor conservada y con más regeneración (Peña et al., 1997a; Peña et al., 1998). En las otras regiones montañosas, las colonias conocidas fueron muy afectadas por la deforestación en el pasado.
La destrucción de hábitat o el tratamiento a cultivos con pesticidas pudo haber causado la extirpación del polinizador. Desde la década de 1980 casi todas las áreas montañosas con colonias perturbadas de Micrcycas están reforestadas, sin embargo estas continúan sin reproducción natural. Las colonias de los llanos son las más perjudicadas por represamientos o cultivos de arroz en los arroyos, algunas han desaparecido, y en otras sólo sobreviven 43 plantas viejas y dañadas, sin producción natural de semillas (Peña et al., 1997a; Peña et al., 1998).
La especie fue categorizada en 1998 como en Peligro Crítico. Esto se justifica porque la suma de las áreas de todas las subpoblaciones es pequeña, junto a que la población está severamente fragmentada y además se infieren declinaciones en área de ocupación, en calidad y área del hábitat, y en el número de hembras reproductoras. También porque el número total de hembras maduras que se reproducen se estima menor que 250, junto a que se infiere que diminuyen, y no suman más de 50 en ninguna de las localidades (Peña et al., 1998). Lo que representa los criterios CR B1+2bce;C2a de la versión 2.3 de 1994 IUCN y los equivalentes CR B2ab(ii, iii, v);C2a(i) de la versión 3.1 de 2001 IUCN.
La especie fue incluida en la Lista Roja de la flora vascular cubana (Berazaín, 2005). También ha sido incluida en la Lista Roja de la IUCN pero se dan otros criterios: CR B1ab(iii, iv, v)+2ab(iii, iv, v) versión 3.1 (2001) (IUCN, 2006). Las mayores amenazas actuales son: interferencia humana, fragmentación del hábitat, construcción de represas, depredación por cerdos o roedores y reproducción severamente limitada (Peña et al., 1998).
Uso, comercio y conservación ex situ
Según reporta Caldwell en 1907, en algunas zonas de la Sierra del Rosario la raíz de Microcycas fue usada como veneno de ratas (Caldwell, 1907). Debido a la belleza de su corona redondeada y sus brillantes foliolos colgantes fue colectada hasta mediados de siglo XX como planta ornamental rara, de la cual se hicieron algunas exportaciones, pero desde entonces prácticamente no se ha explotado (Foster & Rodríguez San Pedro, 1942; Risco et al. 1984; Peña et al., 1998). Resulta una especie comercialmente muy escasa en el mundo (Osborne & Milanés Santana, 1995). Desde 1975 la especie está incluida en el Apéndice I de la convención CITES, que prohíbe el comercio internacional de plantas no reproducidas artificialmente, excepto cuando se autoriza excepcionalmente con fines científicos y de conservación (Donaldson, 2003).
En Cuba casi no se cultiva fuera de sus jardines botánicos y en ellos es muy limitado el número de ejemplares adultos (Osborne & Milanés Santana, 1995). Sin embargo, se han realizado numerosas colectas de semillas y plántulas para su conservación como germoplasma en cultivo en la Red Nacional de Jardines Botánicos de Cuba (Lazcano, 2005).
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Microcycas calocomaCommons.
Wikimedia Commons alberga contenido multimedia sobre Microcycas calocomaCommons.
Véase también
Referencias
- Berazaín Iturralde, R.; Areces Berazaín, F.; Lazcano Lara, J.C.; González Torres, L.R. (2005). Lista roja de la flora vascular cubana. Ayuntamiento de Gijón, Jardín Botánico Atlántico de Gijón (eds.). 86 pp. [http//www.uh.cu/centros/jbn/descargas/listarojacuba.pdf].
- Borhidi, A. (1996). Phytogeography and ecology of Cuba. Akadémiai Kiadó, Budapest.
- Cadwell, O.W.; Baker, C.F (1907). «The identity of Microcycas calocoma». Botanical Gazette 43. 330 – 335.
- Cadwell, O.W. (1907). «Microcycas calocoma. Contributions from the Hull Botanical Laboratory XCVII». Botanical Gazette 44. 118-141.
- Cadwell, O.W. (1909). «Estudios sobre el Microcycas calocoma». Estación Central Agronómica. Segundo Informe, Parte I. 131-142 y Láminas XXIII-XXV.
- Capote, R.P.; Berazaín, R. (1984). «Clasificación de las formaciones vegetales de Cuba.». Revista del Jardín Botánico Nacional, Universidad de La Habana 5. 27-75.
- Carmenate, Hilario (2004). «Exploración al Hoyo del Volcán (¿)». Consultado el 2007.
- Cendrero, O. (1940). «El Microcycas calocoma, palma corcho, palma de corcho o corcho». Memorias de la Sociedad Cubana de Historia Natural ‘Felipe Poey’ 8 (3). 175-182.
- Chamberlain, Charles Joseph (1919). The Living Cycads. University Chicago Press, Chicago.
- Chaves, R.; Genaro, J.A. (2005). «A new species of Pharaxonotha (Coleoptera : Erotylidae), probable pollinator of the endangered Cuban cycad, Microcycas calocoma (Zamiaceae)». Insecta Mundi 19 (3). 143-150.
- Chaw, S.M.; Walters, T.W.: Chang, C.C.; Hu, S.H.; Chen, S.H. (2005). «A phylogeny of cycads (Cycadales) inferred from chloroplast matK gene, trnK intron, and nuclear rDNA ITS region». Molecular Phylogenetics and Evolution 37. 214-234 [1].
- CNPC, Consejo Nacional de Patrimonio Cultural (2007). «Monumentos Nacionales. Myicrocycas Calocoma». Consultado el Mayo de 2007.
- Correoso, L. (1989). «Proclaman Monumentos Nacionales». Granma 6 de junio.
- De Candolle, A. (1868). «Microcycas calocoma». Prodromus Systemalis Naturalis Regnis Vegetabilis 16 (2). 538.
- Donaldson, J. S. [ed.] (2003). Cycads. Status Survey and Conservation Action Plan. IUCN/SSC Cycad Specialist Group. IUCN, Gland, Switzerland and Cambridge, UK.. ix + 86 pp. ISBN 2-8317-0699-8 [2].
- Foster, A. S.; Rodríguez San Pedro, M. (1942). «Field studies on Microcycas calocoma». Memorias de la Sociedad Cubana de Historia Natural ‘Felipe Poey’ 16. 105-121.
- García-Pelayo y Gross, Ramón (1977). Pequeño Larousse Ilustrado. Ediciones Larousse, París. ISBN 2-03-020541-9.
- González Géigel, L (2003). «Zamiaceae». Flora de la República de Cuba, fascículo 8(4) :1-22.. A. R.Gantner Verlag KG. Liechtenstein.. ISBN 3-906166-00-7.
- IUCN (2006). «2006 IUCN Red List of Threatened Species». Consultado el Mayo de 2007.
- IUCN (2001). «The IUCN Red List of Threatened Species. 2001 Categories & Criteria (version 3.1)». Consultado el Mayo de 2007.
- IUCN (1994). «The IUCN Red List of Threatened Species. 1994 Categories & Criteria (version 2.3)». Consultado el Mayo de 2007.
- Jones, D. L. (1993). Cycads of the World. Reed, Chatsworth, NSW, Australia. 312 pp. ISBN 1-56098-220-9.
- Kokubugata, G.; Kondo, K. (1998). «Comparative karyotype analysis of Ceratozamia mexicana and Microcycas calocoma (Zamiaceae) using fluorochrome banding (CMA/DAPI) and fluorescence in situ hybridization of ribosomal DNA». Plant Systematics and Evololution 210: 41–50 210 (1-2). 41-50 [3].
- Lazcano, J.C. (2005). «Conservación ex situ de Microcycas calocoma, Zamia amblyphyllidia, Zamia ottonis y Zamia pygmaea (Zamiaceae) como colecciones vivas en el Jardín Botánico Nacional de Cuba». Revista del Jardín Botánico Nacional, Universidad de La Habana 25(-26). 145-152.
- Mercado, A. (1977). «Raíces coraloides de Microcycas calocoma: estructura, desarrollo y endófitos presentes». Ciencias Biológicas, Académia de Ciencias de Cuba 1. 3-40.
- Miquel, F.A.K. (1851-1852). «Sur une espèce nouvelle de Zamia des Indes Occidentales, introduite dans l'etablissement L. Van Houtte, a Gand». Ed. Van Houtte. Gand.
- Norstog, K.J. (1990). «Spermatozoids of Microcycas calocoma: Ultrastructure». Botanical Gazette 151 (3). 275-284.
- Osborne, R.; Milanés-Santana, R. (1995). «Microcycas calocoma (Miq.) A. DC.». Encephalartos 42. 4-11.
- Peña, E.; Chaves, R.; Pimentel, O. (1988). «Microcycas calocoma: hallazgos interesantes con vistas a sus posibilidades de conservación». Revista del Jardín Botánico Nacional, Universidad de La Habana 9. 84-99.
- Peña, E.; López, P.I.; Lazcano, J.; Pérez, D.; Torriente, Z. (1997a). «La reproducción sexual en Microcycas. I. Estudios de monitoreo in situ». Revista del Jardín Botánico Nacional, Universidad de La Habana 17(-18). 147-158.
- Peña, E.; López, P.I.; Lazcano, J.; Pérez, D.; Torriente, Z. (1998). «CAMP. Hoja de datos de taxón para Zamiaceae: Microcycas calocoma (Miq.) A. DC.». Peña, E.; P. I. López; J. Lazcano; A. T. Leiva and U. S. Seal [eds.]. Memorias del Primer Taller para la Conservación, Análisis y Manejo Planificado de Plantas Silvestres Cubanas CAMP I. Vol. II pp.89-95. IUCN/SSC Conservation Breeding Specialist Group, Apple Valley, MN, USA.
- Peña, E.; López, P.I.; Pérez, D. (1997b). «La reproducción sexual en Microcycas II. El aparato reproductor masculino y la polinización como factor de riesgo». Revista del Jardín Botánico Nacional, Universidad de La Habana 17(-18). 159-167.
- Risco, E. Del; Morell, J.; Samek, V. (1984). «Algunos apuntes sobre Microcycas calocoma (Miq.) A. DC.». Revista del Jardín Botánico Nacional, Universidad de La Habana 5. 111-129.
- Stevenson, D. W. (1992). «A formal classification of the extant cycads». Brittonia 44. 220-223.
- Vovides, A.P.; Ogata, N.; Sosa, V.; Peña-Garcia, E. (1997). «Pollination of endangered Cuban cycad Microcycas calocoma (Miq.) A. DC.». Botanical Journal of the Linnean Society 125. 201-210.
Categorías:- Plantas en peligro crítico de extinción
- Zamiaceae
- Flora endémica de Cuba
Wikimedia foundation. 2010.