- Tetróxido de dinitrógeno
-
Tetróxido de dinitrógeno 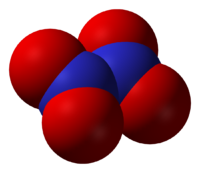
Tetróxido de dinitrógeno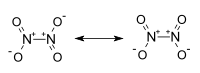
General Nombre sistemático Tetróxido de dinitrógeno
Óxido de nitrógeno (IV)Fórmula química N2O4 Masa molecular 92.011 u Apariencia Gas incoloro Número CAS 10544-72-6 Enlace MSDS Air Liquide MSDS (PDF) Propiedades físicas Densidad 1443 kg/m³ Solubilidad Reacciona en agua Propiedades en estado sólido Entropía molecular
(S0sólido)150,38 J/(mol•K) Densidad ? g/cm3 Seguridad Ingestión ? Innalación Corrosivo y tóxico Contato con la piel Corrosivo Ojos Corrosivo OSHA Exposición permitida
(PEL)5 ppm NIOSH Peligroso para la vida y salud
(IDLH)20 ppm Precauciones Protección personal - Piel: Prevenir contacto
- Ojos: Prevenir contacto
- Lavar Piel: Si hubo contacto
Reacciona con - Material combustible
- Agua
- Organoclorado
- Disulfuro de carbono
- Amoníaco
NFPA 704 El tetraóxido de dinitrógeno N2O4. es un dímero del dióxido de nitrógeno NO2. Por lo cual empleando la nomenclatura de Stock existe una dificultad en la denominación para diferenciar ambos compuestos ya que ambos son óxido de nitrógeno (IV). Además ambos compuestos se encuantran en equilibrio dependiente de la presión y la temperatura.
Es un poderoso oxidante, altamente tóxico y corrosivo. El N2O4 recibió mucha atención como comburente de cohetes debido a que reacciona de forma hipergólica con la hidracina, y derivados, y se puede almacenar con facilidad. Donde se le suele conocer con la abraviatura NTO. También es un poderoso reactivo en síntesis químicas.
Contenido
Estructura y propiedades
Es una molécula plana con un enlace N-N con una distancia de 1,78 Å y los enlaces N-O con distancias de 1,19 Å. El N2O4. A diferencia del NO2, el N2O4 es una molécula diamagnética. En estado puro a 25 °C es un gas incoloro, corrosivo y muy oxidante. Su temperatura crítica es 157'85 °C y su presión critica 10MPa .
Las moleculas de NO2 se combinan para dar su dímero N2O4 y estas se decomponen en NO2. Este proceso esta en equilibrio:

Al aumentar la presión, aumenta la concentración de N2O4, mientras que disminuye la de NO2
El valor de la constante de disociación depende significativamente de la temperatura.[1]T en °C 0 8,7 25 35 45 50 86,5 101,5 130,8 Kd en atm 0,0177 0,0374 0,174 0,302 0,628 0,863 7,499 16,18 59,43 A altas temperaturas el equilibrio se desplaza hacia la derecha, aumentando la concentración de NO2. Como este último es de color pardo la mezcla adquiere una tonalidad del rojiza virando a un pardo mas intenso cuanto mayor sea la descompoción. A temperatura superiores a 80 °C la disociacion aumenta rapidamente y a 140 °C esta casi completamente disociado. Se puede apreciar el efecto inverso al disminuir la temperatura.
El estado líquido consiste principalmente en el dímero N2O4. Es un líquido volátil con un olor acre de color marrón amarillento, debido a la mezcla de dióxido de nitrógeno. El punto de ebullición a presión atmosférica, +21,15 ° C, solidificación a -11 ° C. El sólido a temperaturas inferiores a -12 ° C es incoloro. Reacciona con el agua para formar una mezcla de ácidos nítrico y nitroso: 2NO2 + H 2 O = HNO 3 + HNO 2
Sus mezclas con sustancias orgánicas son explosivas.
Producción
Industrial
Una manera de sintetizarlo es mediante la oxidación catalitica del amoníaco: el vapor se emplea para reducir la temperatura de combustión. La mayoría del agua se condensa, y los gases se enfrían aun mas. El óxido nítrico producido se oxida a dióxido de nitrógeno, y el resto del agua se elimina con ácido nítrico. El gas resultante es tetraóxido de dinitrógeno prácticamente puro, que se condensa gracias a una refrigeración con salmuera.
Pero la forma habitual es obtener el tetraóxido de dinitrógeno como subproducto de una planta de ácido nitrico. Se oxida al aire el óxido nítrico NO producido a dióxido de nitrógeno. Al enfriarse forma su dímero, el tetraóxido de dinitrógeno.
Laboratorio
En el laboratorio se puede obtener de manera similar, o bien por reducción del ácido nítrico concentrado con cobre o calentando nitratos de metales pesados tales como nitrato de plomo o de nitrato de plata en una corriente de oxígeno.
Almacenamiento
El tetróxido de nitrógeno se almacena en tanques de acero inoxidable o de aluminio de hasta 100 m³. Los tanques estan equipados Slivno lleno de tubos, válvulas de seguridad, manómetros y medidores . Como el intervalo donde permanece en estado líquido es muy estrecho (desde 262º a 294,3ºK ), los depósitos se colocan en las salas subterráneas donde la temperatura se mantiene entre 268º y 288ºK .
Las peculiaridades de tetróxido de nitrógeno de almacenamiento se puede atribuir la saturación de los componentes con nitrógeno o aire en el tanque y mantener la presión alta 0,15 a 0,22 MPa . Esto se hace en primer lugar, para evitar entrar en el oxidante desde la atmósfera, humedad o contaminantes, y, en segundo lugar, para reducir el tiempo de saturación cuando se llena de gas misiles . Cohetes repostados también tienen un exceso de presión, lo que elimina la cavitación en la unidad turbo-bomba (TPU) para operar del sistema de propulsión .
Transporte
El tetróxido de nitrógeno se transporte en tanques especiales con aislamiento y un sistema de tuberías que, dependiendo de la temperatura ambiente recirculan agua caliente o una solución refrigerante.
El tetróxido de dinitrógeno se transporta en sobrepresión de 0,1 a 0,15 MPa . En cisternas ferroviarias y camiones equipados con válvulas de seguridad , manómetros y medidores . Los vagones cisterna con una capacidad de alrededor de 40 m³, los camiones de 30 a 60 m³.
Empleo
Combustible de cohetes
Es ampliamente utilizado en los cohetes como comburente de elevado punto de ebullición. En los motores cohete se emplea en conjunción con combustibles a base de derivados de hidracina ( metilhidrazina , dimetilhidracina asimétrica ).
El tetraóxido de dinitrógeno en combinación con el combustible alqilhidracina forma una pareja hipergólica con un tiempo de retardo de encendido de aproximadamente 0,003 seg.
En la etapa inicial fue utilizado en una solución de ácido nítrico , debido a la alta temperatura de transición al estado sólido. De acuerdo con el grado de utilización sólo es superado por el oxígeno líquido.
El tetróxido de dinitrógeno en primer lugar se empezó a utilizar tanto en EE.UU. como en la URSS como oxidante almacenables sin refrigeración en el misiles balísticos intercontinentales de segunda generación, a finales de 1950, como el Titan II. Esto permitía mantenerlos en alerta siempre con el depósito lleno y listo para su disparo inmediato. La generación anterior que usaba oxigeno líquido no podía, debía almacenarlo en condiciones especiales.
Después se emplearía en los lanzadores espaciales derivados de estos misiles intercontinetales. Uno de los primeros usos de esta combinación fue en el cohetes Titan utilizado originalmente como misiles balísticos intercontinentales y luego como los vehículos de lanzamiento para muchas naves espaciales. Utilizado en el Gemini de EE.UU., la nave espacial Apolo y del transbordador espacial. Se sigue utilizando en la mayoría de los satélites geoestacionarios, y muchas sondas del espacio profundo. Ahora parece probable que la NASA continuará usando este oxidante en la próxima generación de "vehículos tripulados", que sustituirá a la lanzadera. También es el oxidante principal de cohete rusos Protón, Cosmos , Tsyklon (en versión AK-27I ), los franceses - "Arian " y los chinos Larga Marcha .
Cuando se utiliza como propelente, el tetróxido de dinitrógeno se suele llamar simplemente "tetróxido de nitrógeno" se utiliza ampliamente la abreviatura "NTO". Además, a menudo se emplea con la adición de un pequeño porcentaje de óxido nítrico , que inhibe la corrosión bajo tensión de las aleaciones de titanio, y de esta forma, el NTO con calidad de propulsor se conoce como "mezcla de óxidos de nitrógeno" o "MON " . La mayoría de naves espaciales utilizan ahora MON en lugar de NTO. Por ejemplo, el transbordador espacial de reacción del sistema de control utiliza MON3 (NTO con un 3% en peso de NO)
El 24 de julio de 1975, el NTO casi mató por envenenamiento a los tres astronautas de EE.UU. a bordo del proyecto de prueba Apollo-Soyuz durante su descenso final. Un miembro de la tripulación perdió el conocimiento durante el descenso. Al aterrizar, la tripulación fue hospitalizado 14 días por neumonía y edema inducidos quimicamente.
Generación de energía
La propiedad del N2 O4 para disociarse de forma reversible en NO2 ha promovido una investigación para su uso en sistemas avanzados de generación de energía. El tetróxido de nitrógeno relativamente frio se comprime y a continuación se calienta, provocando que se disocian en dióxido de nitrógeno con la mitad del peso molecular. Este dióxido de nitrógeno caliente se expande a través de una turbina, enfriandose y disminuyendo la presión, y luego se enfría aún más en un disipador de calor, haciendo que se recombine en tetróxido de denitrógeno con el peso molecular original. Es entonces mucho más fácil de comprimir para iniciar el ciclo otra vez. Tal disociación del gas el ciclo Brayton tienen potencial para aumentar considerablemente la eficiencia de los equipos de conversión de energía.
Sintesis química
Si los nitratos de metales se preparan a partir N2O4 en condiciones completamente anhidras, se pueden formar una serie de nitratos metálicos covalentes con muchos metales de transición. Esto se debe a que existe una preferencia termodinámica del ion nitrato para unirse covalentemente con metales en lugar de formar una estructura iónica. Estos compuestos se deben preparar en condiciones anhidras, ya que el ion nitrato forma una ligandura mucho más débil que el agua, y si el agua está presente el nitrato hidratado sencillo formulario. Los nitratos anhidro son covalentes, y de muchos, por ejemplo, el nitrato de cobre anhidro, son volátiles a temperatura ambiente. El nitrato de titanio anhidro sublima en vacío a sólo 40 °C. Muchos de los nitratos metálicos anhidros de transición tiene colores llamativos. Esta rama de la química fue desarrollada por Clifford Addisson y Logan Noramn en la Universidad de Nottingham en el Reino Unido durante los años 1960 y 1970, cuando comenzaron a estar disponibles desecantes de alta eficiencia y cajas secas.
Referencias
- ↑ J. Chao; R.C. Wilhoit; B.J. Zwolinski: Gas phase chemical equilibrium in dinitrogen trioxide and dinitrogen tetroxide in Thermochim. Acta 10 (1974) 359-371, doi 10.1016/0040-6031(74)87005-X.
Categorías:- Óxidos de nitrógeno
- Combustibles para cohetes
Wikimedia foundation. 2010.


