- Hidrazina
-
Hidrazina
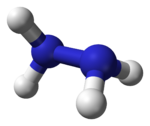
Nombre (IUPAC) sistemático Hidrazina General Fórmula semidesarrollada NH2-NH2 Fórmula estructural 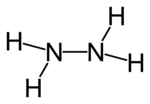
Fórmula molecular N2H4 Identificadores Número CAS 302-01-2 Propiedades físicas Estado de agregación Líquido Apariencia Incoloro Densidad 1.010 kg/m3; 1,01 g/cm3 Masa molar 32,0 g/mol Punto de fusión 274 K (0,85000000000002 °C) Punto de ebullición 387 K (113,85 °C) Propiedades químicas Solubilidad en agua Muy soluble Termoquímica ΔfH0gas 95,35 kJ/mol ΔfH0líquido 50,63 kJ/mol ΔfH0sólido 37,63 kJ/mol S0gas, 1 bar 238,66 J·mol-1·K-1 S0líquido, 1 bar 121,52 J·mol-1·K-1 Riesgos Ingestión Tóxico, posiblemente un agente carcinógeno. Inhalación Muy peligroso, extremadamente destructivo para el tracto respiratorio. Piel Puede causar quemaduras severas, puede ser absorbido por la sangre. Ojos Puede causar daños permanentes. Más información Hazardous Chemical Database (En inglés) Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa hidracina o hidrazina es un compuesto químico cuya fórmula química condensada es N2H4.
Se trata de un líquido incoloro y oleoso, con un olor similar al del amoníaco y que libera vapores cuando está expuesto al aire. Quema con llama apenas visible. Comercialmente se suministra en disolución acuosa o como hidrato de hidracina (H2N−NH2 · H2O).
Se utiliza principalmente como espumante para la preparación de espumas poliméricas así como precursor de catalizadores de polimerización y fármacos. Adicionalmente se emplea como combustible para misiles, cohetes espaciales y satélites. El comburente utilizado habitualmente en estos casos es el tetróxido de dinitrógeno. También se conoce como hidrazinas a los compuestos derivados de éste.
Generalmente no se utiliza la hidrazina, sino algunos de sus derivados como la monometilhidrazina o la dimetilhidrazina asimétrica. Su empleo comporta importantes ventajas, como ser almacenable a temperatura ambiente y producir ignición en cuanto entra en contacto con el carburante (a este tipo de combustibles se les llama hipergólicos). Sin embargo, debido a su alta toxicidad, se tiende a abandonar su uso.
Es importante mencionar que este compuesto químico reacciona con el oxígeno de la siguiente manera: N2H4 + O2 → N2 + 2 H2O, reduciendo la posibilidad de corrosión por oxidación en los metales. Además al entrar en contacto con el óxido férrico, genera magnetita, agua y nitrógeno: N2H4 + 6 Fe2O3 → 4 Fe3O4 + 2 H2O + N2.
El 21 de febrero de 2008 los Estados Unidos de América destruyeron un satélite espía, también estadounidense, que estaba fuera de control, alegando que su depósito de combustible estaba lleno de hidrazina y que ésta podría extenderse sobre algún área poblada.
El 29 de febrero de 2008 se produjo un accidente con dos camiones que transportaban hidrazina, en San Carlos de Bariloche, una ciudad de Argentina que pertenece a la provincia de Río Negro, y es la cabecera del Departamento de Bariloche. No hubo ningún herido, aunque uno de los camioneros estaba mareado por los humos.
Véase también
Referencias externas
- ATSDR en Español - ToxFAQs™: hidrazinas
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la hidrazina.
- Monometilhidrazina en la Encyclopedia Astronautica (en inglés)
- Dimetilhidrazina asimétrica en la Encyclopedia Astronautica (en inglés)
Wikimedia foundation. 2010.
