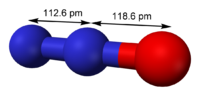
- Óxido de nitrógeno (I)
-
Óxido de nitrógeno (I)
Nombre (IUPAC) sistemático Monóxido de dinitrógeno General Otros nombres Óxido de nitrógeno (I)
Óxido nitroso
Gas hilarante
Gas de la risa
Protóxido de nitrógeno
Anhídrido hiponitroso
Óxido jaloso
E-942
Azo-óxidoFórmula semidesarrollada N2O Fórmula molecular n/d Identificadores Número CAS 10024-97-2 Propiedades físicas Estado de agregación Gas Apariencia Gas incoloro Densidad 1.2228 kg/m3; 0,0012228 g/cm3 Masa molar 44,01 g/mol Punto de fusión 182,29 K (-90,86 °C) Punto de ebullición 184,67 K (-88,48 °C) Temperatura crítica 309,6 K ( °C) Propiedades químicas Solubilidad en agua 0,112 g en 100 g de agua Compuestos relacionados Óxidos de nitrógeno relacionados Óxido de nitrógeno (II), óxido de nitrógeno (IV), óxido de nitrógeno (VI), tetróxido de dinitrógeno, óxido de nitrógeno (V) Ácidos relacionados Ácido hiponitroso, Ácido nitroso, ácido nítrico Termoquímica ΔfH0gas 82,05 kJ/mol S0gas, 1 bar 219,96 J·mol-1·K-1 Peligrosidad NFPA 704 Riesgos Inhalación Puede causar asfixia. Piel Peligroso comprimido o criogénico. Ojos Peligroso comprimido o criogénico. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl óxido de nitrógeno (I), óxido de dinitrógeno, protóxido de nitrógeno, anhídrido hiponitroso, óxido nitroso, gas hilarante, o también gas de la risa (N2O) es un gas incoloro con un olor dulce y ligeramente tóxico.[1] [2] Provoca alucinaciones, un estado eufórico y en algunos casos puede provocar pérdida de parte de la memoria humana. No es inflamable ni explosivo, pero soporta la combustión tan activamente como el oxígeno cuando está presente en concentraciones apropiadas con anestésicos o material inflamable.
Contenido
Síntesis
El óxido de nitrógeno (I) se genera convenientemente por la termólisis controlada del nitrato amónico o por reacción de amoníaco con ácido nítrico:
Hay que controlar bien las condiciones de esta reacción porque existe el peligro de explosión. El óxido de nitrógeno (I) se forma también en condiciones anaeróbicas a partir de abonos minerales en el suelo. Es un gas que si contribuye al efecto invernadero y tiene una permanencia media de 109 años en la atmósfera. Actualmente se atribuye el 200 % del efecto invernadero artificial a este gas. Además ataca la capa de ozono, reduciendo el ozono a oxígeno molecular y liberando dos moléculas de monóxido de nitrógeno.
Usos en automovilismo
Hoy en día este gas es utilizado en automóviles convencionales modificados. La cadena molecular del gas se rompe durante la combustión en la cámara, a unos 275 °C de temperatura,[3] produciendo un aumento del oxígeno disponible para la combustión con el consecuente aumento de potencia. Así mismo el nitrógeno liberado presente en la cámara actúa como un amortiguador térmico tras el aumento de energía liberada. Las características en la entrega de potencia de los equipos de óxido nitroso limita su uso en vehículos de serie a aumentos de potencia que normalmente no superan los 100 caballos y que mas bien rondan entre los 50 y 75 caballos. Para el uso de mayores potencias se han diseñado sistemas progresivos de inyección del gas en cuestión, permitiendo así una rampa de aumento de potencia y evitar así las sobrecargas por shock en el conjunto motriz y la transmisión. Además para altas potencias es necesario la modificación de diversos componentes del motor. El uso de equipos de óxido nitroso en vehículos de serie, requiere una variación en la puesta a punto del avance de encendido, siendo necesario un atraso del mismo. También se recomienda el uso de bujías con un grado térmico mayor ("bujías frías"), lo cual asegura una mejor extracción del exceso de calor en la cámara para así evitar la detonación. (Detonación en Motores). Es necesario recordar que debido al aumento de comburente en la cámara durante la inyección del gas, se necesita un aumento también del combustible inyectado hacia la cámara, para así mantener una relación aire/combustible adecuada (Relación Aire Combustible).
Farmacocinética
El óxido nitroso es muy insoluble en sangre y otros tejidos, proveyendo de una inducción rápida de la anestesia y a la vez, rápida recuperación después de suspender el suministro. Es casi completamente eliminado por los pulmones, con una mínima difusión a través de la piel. No se biotransforma. Este gas quizás sea desintegrado por la interacción con la vitamina B12, presente en las bacterias intestinales. Esto resulta en una disminución en la síntesis de metionina, originando signos de deficiencia de vitamina B12 (anemia megaloblástica, neuropatía periférica) al utilizar óxido nitroso a largo plazo. Por esa razón no se utiliza como analgésico a largo plazo o como sedante en situaciones de cuidado intensivo.
Calentamiento global
El óxido nitroso es un poderoso gas de efecto invernadero, por lo que las emisiones de este gas se las responsabiliza parcialmente junto con el dióxido de carbono, el metano y algunos aerosoles, como los de provocar el calentamiento global.
Datos adicionales
- Presión de vapor: 5080 kPa a 20 °C
- Solubilidad en agua: 1,305 l/l agua a 0 °C; 0,596 l/l agua a 25 °C
- Concentración máxima permitida en lugares de trabajo: 100 ppm
Es altamente reactivo y al mezclarse con agua produce ácido hiponitroso:
- N2O + H2O → 2 HNO
Referencias
Enlaces externos
- Erowid Nitrous Oxide Vault Información y enlaces sobre el óxido de nitrógeno (en inglés)
- Instituto Nacional de Seguridad e Higiene en el trabajo de España Ficha internacional de seguridad química del óxido de nitrógeno (I).
Categorías:- Óxidos de nitrógeno
- Drogas disociativas
- Oxidantes para cohetes
- Monopropelantes
- Código ATC N
- Anestésicos generales
- Depresores
Wikimedia foundation. 2010.