- Perclorato
-
Perclorato
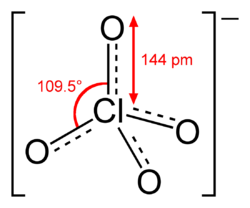
Los percloratos son las sales del ácido perclórico HClO4. Contienen el cloro en estado de oxidación +VII en un entorno tetraédrico de cuatro átomos de oxígeno. La carga negativa es estabilizada por efectos mesoméricos a través de todo el ion. La relativa estabilidad del perclorato a pesar del elevado estado de oxidación del átomo central se atribuye a la elevada simetría que presenta el ion.
Contenido
Aplicaciones
Los percloratos se utilizan en formulaciones en pirotécnica, en la elaboración de explosivos y combustibles de cohetes. Además se emplean como herbicidas.
En química inorgánica se utilizan como contraión no coordinante. Debido a la explosividad de algunas de las sales obtenidas se intenta restringir este uso sustituyéndolo por tetrafenilborato, hexaflurofosfato, etc.
En farmacología clínica, el perclorato potásico se utiliza como antitiroideo.[1]
Síntesis
Los percloratos se obtienen por oxidación anódica de los cloratos con altas densidades de corriente eléctrica en electrodos de platino. El perclorato potásico es relativamente poco soluble y precipita del medio de reacción.
Referencias.
- ↑ Véase ATC index 2008 para los Percloratos, de la página web del WHO Collaborating Centre for Drug Statistics Methodology del Instituto Noruego de Salud Pública (enlace consultado el 26 de octubre de 2008).
Enlaces externos
- ATSDR en Español - ToxFAQs™: Percloratos Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Percloratos Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
Categorías: Percloratos | Aniones no coordinantes
Wikimedia foundation. 2010.