- Reactivo de Lucas
-
Reactivo de Lucas
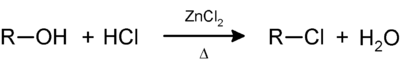
El reactivo de Lucas es una solución de cloruro de zinc en ácido clorhídrico concentrado, usado para clasificar alcoholes de baja masa molar. La reacción es una sustitución en la que el cloro reemplaza al grupo hidroxilo. Aunque esta reacción normalmente es muy desfavorable, el ion zinc forma complejo con el grupo hidroxilo (al aceptar un par electrónico del O del -OH), haciéndolo un mejor grupo saliente. El carbocatión remanente se combina a continuación con el ion cloruro para formar un cloroalcano.
Prueba de Lucas
La prueba de Lucas, en los alcoholes es un ensayo químico para diferenciar entre alcoholes primarios, secundarios y terciarios. Se basa en la diferencia en reactividad de los tres tipos de alcoholes con halogenuros de hidrógeno.
Cuando se agrega el reactivo de Lucas (ZnCl2 en solución de HCl concentrado) al alcohol, H+ del HCl protonará el grupo -OH del alcohol, tal que el grupo saliente H2O, siendo un nucleófilo más débil que el OH-, pueda ser sustituido por el nucleófilo Cl-. El reactivo de Lucas ofrece un medio polar en el que el mecanismo SN1 está favorecido. En la sustitución nucleofílica unimolecular, la velocidad de reacción es más rápida cuando el carbocatión intermediario está más estabilizado por un mayor número de grupos alquilo (R-) donantes de electrones, unidos al átomo de carbono cargado positivamente. Los alcoholes terciarios reaccionan inmediatamente con el reactivo de Lucas para producir turbidez, mientras que los alcoholes secundarios lo hacen en cinco minutos. Los alcoholes primarios no reaccionan significativamente con el reactivo de Lucas a temperatura ambiente.
El reactivo disuelve al alcohol, eliminando el grupo OH, formando un carbocatión. La velocidad de esta reacción es proporcional a la energía requerida para formar el carbocatión, así que los carbocationes terciarios, bencílicos, alílicos reaccionan rápidamente, mientras que los alcoholes más pequeños, menos sustituidos, reaccionan más lentamente. La turbidez observada se debe al carbocatión que reacciona inmediatamente con el anión cloruro, creando un cloroalcano insoluble.
De ahí que, el tiempo que toma la turbidez en aparecer es una medida de la reactividad del tipo de alcohol con el reactivo de Lucas, y esto es utilizado para diferenciar entre las tres clases de alcoholes:
- no hay reacción visible: alcohol primario
- la solución se turbia en 3-5 minutos: alcohol secundario
- la solución se vuelve turbia inmediatamente, y/o las fases se separan: alcohol terciario, bencílico o alílico
La prueba es llevada a cabo generalmente a temperatura ambiente.
Enlaces externos
- «Lucas Test for Primary, Secondary, and Tertiary Alcohols (video)». Journal of Chemical Education (2001).
Categorías: Alcoholes | Pruebas químicas
Wikimedia foundation. 2010.