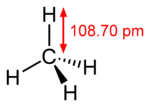- Metano
-
Propiedades Generales
Nombre Metano Fórmula química CH4 Peso atómico 16,043 uma Densidad 0.717 kg/m3 (gas) Otras denominaciones Gas del pantano; hidruro de metilo; tetrahidruro de carbono Número CAS 74-82-8 Cambios de fase
Punto de fusión 90,6 K (-182,5 °C) Punto de ebullición 111,55 K (-161,6 °C) Punto triple 90,67 K (-182,48 °C)
0,117 bar
Punto crítico 190,6 K (-82,6 °C)
46 bar
Punto de inflamación -188 °C Temperatura de autoignición 537 °C Límite explosivos 5-15% Más información
Properties NIST WebBook MSDS Hazardous Chemical Database Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referencias
El metano (del griego methy vino, y el sufijo -ano[1] ) es el hidrocarburo alcano más sencillo, cuya fórmula química es CH4.
Cada uno de los átomos de hidrógeno está unido al carbono por medio de un enlace covalente. Es una sustancia no polar que se presenta en forma de gas a temperaturas y presiones ordinarias. Es incoloro e inoloro y apenas soluble en agua en su fase líquida.
En la naturaleza se produce como producto final de la putrefacción anaeróbica de las plantas. Este proceso natural se puede aprovechar para producir biogás. Muchos microorganismos anaeróbicos lo generan utilizando el CO2 como aceptor final de electrones.
Constituye hasta el 97% del gas natural. En las minas de carbón se le llama grisú y es muy peligroso ya que es fácilmente inflamable y explosivo.
El metano es un gas de efecto invernadero relativamente potente que contribuye al calentamiento global del planeta Tierra ya que tiene un potencial de calentamiento global de 23.[2] Esto significa que en una media de tiempo de 100 años cada kg de CH4 calienta la Tierra 23 veces más que la misma masa de CO2, sin embargo hay aproximadamente 220 veces más dióxido de carbono en la atmósfera de la Tierra que metano por lo que el metano contribuye de manera menos importante al efecto invernadero.
Contenido
Propiedades
El metano es el componente mayoritario del gas natural, aproximadamente un 97% en volumen a temperatura ambiente y presión estándar, por lo que se deduce que en condiciones estándar de 0 °C y una atmósfera de presión tiene un comportamiento de gas ideal y el volumen se determina en función del componente mayoritario de la mezcla, lo que quiere decir que en un recipiente de un metro cúbico al 100% de mezcla habrá 0.97 metros cúbicos de gas natural; el metano es un gas incoloro e inodoro. Como medida de seguridad se añade un odorífero, habitualmente metanotiol o etanotiol. El metano tiene un punto de ebullición de -161,5 °C a una atmósfera y un punto de fusión de -183 °C. Como gas es sólo inflamable en un estrecho intervalo de concentración en el aire (5-15%). El metano líquido no es combustible.
Riesgos potenciales sobre la salud
El metano no es tóxico. Su principal peligro para la salud son las quemaduras que puede provocar si entra en ignición. Es altamente inflamable y puede formar mezclas explosivas con el aire. El metano reacciona violentamente con oxidantes, halógenos y algunos compuestos halogenados. El metano es también un asfixiante y puede desplazar al oxígeno en un espacio cerrado. La asfixia puede sobrevenir si la concentración de oxígeno se reduce por debajo del 19,5% por desplazamiento. Las concentraciones a las cuales se forman las barreras explosivas o inflamables son mucho más pequeñas que las concentraciones en las que el riesgo de asfixia es significativo. Si hay estructuras construidas sobre o cerca de vertederos, el metano desprendido puede penetrar en el interior de los edificios y exponer a los ocupantes a niveles significativos de metano. Algunos edificios tienen sistemas por debajo de sus cimientos para capturar este gas y expulsarlo del edificio. Un ejemplo de este tipo de sistema se encuentra en el edificio Dakin, Brisbane, California.
Reacciones
Las principales reacciones del metano son: combustión, reformación con vapor (steam reforming) para dar gas de síntesis (syngas), y halogenación. En general, las reacciones del metano son difíciles de controlar. Por ejemplo, la oxidación parcial para llegar a metanol es difícil de conseguir; la reacción normalmente prosigue hasta dar dióxido de carbono y agua.
Combustión
En la combustión del metano hay involucrados una serie de pasos:
Se cree que el metano reacciona en primer lugar con el oxígeno para formar formaldehído (HCHO o H2CO). Acto seguido el formaldehído se descompone en el radical formil, que a continuación da monóxido de carbono e hidrógeno. Este proceso es conocido en su conjunto como pirólisis oxidativa.
- CH4 + O2 → CO + H2+ H2O
Siguiendo la pirolisis oxidativa, el H2 se oxida formando H2O, desprendiendo calor. Este proceso es muy rápido, siendo su duración habitual inferior a un milisegundo.
- 2H2+ O2→ 2H2O
Finalmente el CO se oxida, formando CO2 y liberando más calor. Este proceso generalmente es más lento que el resto de pasos, y requiere unos cuantos milisegundos para producirse.
Reformación
El enlace covalente carbono-hidrógeno se encuentra entre los más fuertes de todos los hidrocarburos, y por tanto su uso como materia prima es limitado. A pesar de la alta energía de activación necesaria para romper el enlace CH, el metano es todavía el principal material de partida para fabricar hidrógeno mediante reformación con vapor. La búsqueda de catalizadores que puedan facilitar la activación del enlace CH en el metano y otros alcanos ligeros es un área de investigación de gran importancia industrial.
Halogenación
El metano reacciona con los halógenos bajo las condiciones adecuadas. La reacción tiene lugar de la siguiente manera.
- CH4+ X2|→ CH3X + HX))
En donde X es un halógeno: flúor (F), Cloro (Cl), Bromo (Br) y a veces Yodo (I). El mecanismo de esta reacción es el de halogenación por radicales libres.
Usos
Combustible
Para más información del uso del metano como combustible, consulte: gas natural .
El metano es importante para la generación eléctrica ya que se emplea como combustible en las turbinas de gas o en generadores de vapor.
Si bien su calor de combustión, de unos 802 kJ/mol, es el menor de todos los hidrocarburos, si se divide por su masa molecular (16 g/mol) se encuentra que el metano, el más simple de los hidrocarburos , produce más cantidad de calor por unidad de masa que otros hidrocarburos más complejos. En muchas ciudades, el metano se transporta en tuberías hasta las casas para ser empleado como combustible para la calefacción y para cocinar. En este contexto se le llama gas natural. En la ciudad de Bogotá, Colombia el gas natural es empleado como combustible alterno por varios vehículos de transporte público como taxis, pero en la fecha de este agregado al párrafo (año 2010) su uso se ha generalizado mundialmente, siendo Afghanistán y la Argentina los países donde mas vehículos (en total absoluto y en proporción sobre el total de vehículos) lo usan como combustible.
Usos industriales
El metano es utilizado en procesos químicos industriales y puede ser transportado como líquido refrigerado (gas natural licuado, o GNL). Mientras que las fugas de un contenedor refrigerado son inicialmente más pesadas que el aire debido a la alta densidad del gas frío, a temperatura ambiente el gas es más ligero que el aire. Los gasoductos transportan grandes cantidades de gas natural, del que el metano es el principal componente.
En la industria química, el metano es la materia prima elegida para la producción de hidrógeno, metanol, ácido acético y anhidro acético. Cuando se emplea para producir cualquiera de estos productos químicos, el metano se transforma primero en gas de síntesis, una mezcla de monóxido de carbono e hidrógeno, mediante reformación por vapor. En este proceso, el metano y el vapor de agua reaccionan con la ayuda de un catalizador de níquel a altas temperaturas (700 -1.100 °C).
- CH4+ H2O → CO + 3H2
La proporción de monóxido de carbono frente al hidrógeno puede ser ajustada mediante la reacción de desplazamiento de gas de agua al valor deseado.
- CO + H2O → CO2+ H2
Otros productos químicos menos importantes derivados del metano incluyen el acetileno obtenido haciendo pasar metano a través de un arco eléctrico, y los clorometanos (clorometano, diclorometano, cloroformo, y tetracloruro de carbono), producidos por medio de la reacción del metano con cloro en forma de gas . Sin embargo, el uso de estos productos está disminuyendo, el acetileno está siendo reemplazado por sustitutos más económicos y los clorometanos debido a motivos de salud y medioambientales.
Fuentes
Fuentes naturales
El 60% de las emisiones en todo el mundo es de origen antropogénico. Proceden principalmente de actividades agrícolas y otras actividades humanas.
La mayor fuente de metano es su extracción de los depósitos geológicos conocidos como campos de gas natural. Se encuentra asociado a otros hidrocarburos combustibles y a veces acompañado por helio y nitrógeno. El gas, especialmente el situado en formaciones poco profundas (baja presión), se forma por la descomposición anaeróbica de materia orgánica y el resto se cree que proviene de la lenta desgasificación de los materiales primordiales situados en las partes más profundas del planeta, tal como lo demuestra la presencia de hasta un 7% helio en ciertos yacimientos de gas natural. En términos generales, los depósitos de gas se generan en sedimentos enterrados a mayor profundidad y más altas temperaturas que los que dan lugar al petróleo.
También se puede extraer metano de los depósitos de carbón (CMB son sus siglas en inglés) mediante la perforación de pozos en las capas de carbón, bombeando a continuación el agua de la veta para producir una despresurización lo que permite la desabsorción del metano y su subida por el pozo hasta la superficie. Con esta técnica se produce el 7% del gas natural de los Estados Unidos, si bien puede haber problemas medioambientales debido a la bajada del nivel de los acuíferos y a la presencia de contaminantes en el agua extraída.
Los hidratos de metano o clatratos (combinaciones de hielo y metano en el fondo marino) son una futura fuente potencial de metano, si bien hasta ahora no existe ninguna explotación comercial de la misma.
Los procesos en la digestión y defecación de animales (especialmente del ganado): 17%. Las bacterias en plantaciones de arroz: 12%. La digestión anaeróbica de la biomasa.
Fuentes alternativas
Además de los campos de gas natural una forma alternativa para obtener metano es mediante el biogás generado por la fermentación de materia orgánica que se encuentra en los estiércoles, en los lodos de las aguas residuales, en la basura doméstica, o en cualquier otra materia prima biodegradable, bajo condiciones anaeróbicas.
El metano también se puede obtener industrialmente empleando como materias primas el hidrógeno (el cual se puede obtener mediante electrólisis) y el dióxido de carbono mediante el proceso Sabatier.
- CO2+ 4H2→ CH4+ 2H2O.
Metano en la atmósfera de la Tierra
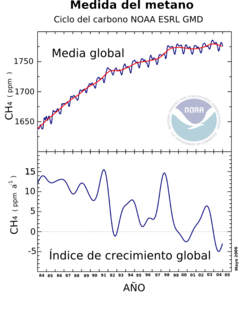
 Resultado de las observaciones de metano desde 1996 a 2005 que muestran el aumento del metano, las variaciones estacionales y la diferencia entre los hemisferios norte y sur.
Resultado de las observaciones de metano desde 1996 a 2005 que muestran el aumento del metano, las variaciones estacionales y la diferencia entre los hemisferios norte y sur.
El metano es un gas de efecto invernadero muy importante en la atmósfera de la Tierra con un potencial de calentamiento de 23 sobre un período de 100 años. Esto implica que la emisión de una tonelada de metano tendrá 23 veces el impacto de la emisión de una tonelada de dióxido de carbono durante los siguientes cien años. El metano tiene un gran efecto por un breve período (aproximadamente 10 años), mientras que el dióxido de carbono tiene un pequeño efecto por un período prolongado (sobre los 100 años). Debido a esta diferencia en el efecto y el periodo, el potencial de calentamiento global del metano en un plazo de 20 años es de 63.
La concentración de metano en la atmósfera ha aumentado durante los últimos cinco mil años. La explicación más probable de este aumento continuado reside en las innovaciones asociadas al comienzo de la agricultura, sobre todo probablemente al desvío de los ríos para el riego del arroz.[3]
Hace unos siete mil años, en Oriente Próximo se descubrió la técnica del regadío y luego esta práctica se extendió hasta el sureste asiático y el sur de China, creando así humedales artificiales. En estos humedales, la vegetación crecía, moría, se descomponía y emitía metano.[3]
La concentración de metano se ha incrementado un 150% desde 1750 y es responsable del 20% del forzante radiativo total de todos los gases de efecto invernadero de larga vida y distribución global.[4]
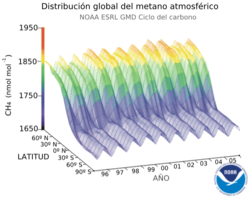
La concentración media de metano en la superficie de la tierra el año 1998 era de 1.745 ppm.[5] Su concentración es más alta en el hemisferio norte porque la mayoría de las fuentes (naturales y antropogénicas) son mayores en ese hemisferio. Las concentraciones varían estacionalmente con un mínimo a finales del verano.
El metano se forma cerca de la superficie, y es transportado a la estratosfera por el aire ascendente de los trópicos. El aumento de metano en la atmósfera de la Tierra es controlado naturalmente -aunque la influencia humana puede interferir en esta regulación- por la reacción del metano con el radical hidroxilo, una molécula formada por la reacción del oxígeno con el agua.
Al principio de la historia de la Tierra -aproximadamente hace 3.500 millones de años- había 1.000 veces más metano en la atmósfera que en la actualidad. El metano primordial fue liberado por la actividad volcánica. Fue durante esta época cuando apareció la vida en la Tierra. Entre las primeras formas de vida se encontraban bacterias metanógenas que mediante el hidrógeno y el dióxido de carbono generaban metano y agua.
El oxígeno no fue un componente mayoritario de la atmósfera hasta que los organismos fotosintéticos aparecieron más tarde en la historia de la Tierra. Sin oxígeno al metano podía permanecer en la atmósfera más tiempo y además en otras concentraciones que en las actuales condiciones.
Emisiones de metano
Houweling y cols. (1999) dan los siguientes valores para las emisiones de metano (Tg/a: teragramos por año):[5]
Origen Emisiones de CH4 Masa (Tg/año) Porcentaje (%/año) Total (%/año) Emisiones naturales Humedales (incl. arrozales) 225 83 37 Termitas 20 7 3 Océano 15 6 3 Hidratos 10 4 2 Total Natural 270 100 45 Emisiones antropogénicas Energía 110 33 18 Basureros 40 12 7 Ganadería de Rumiantes
(bovinos)115 35 19 Tratamiento de desechos 25 8 4 Combustión de Biomasa 40 12 7 Total Antropogénico 330 100 55 Sumideros Suelos 30 5 5 OH Troposférico 510 88 85 Pérdida estratosfèrica 40 7 7 Total sumideros 580 100 97 Emisiones - Sumideros Desequilibrio (tendencia) +20 ~2.78 Tg/ppmm +7.19 ppmm/a Casi la mitad de la emisión total se debe a la actividad humana.[4] Las plantas (p. ej. Los bosques) han sido recientemente identificadas como una importante fuente de metano. Un artículo reciente ha calculado unas emisiones anuales de 62-236 millones de toneladas y que esta nueva fuente puede tener implicaciones importantes.[6] [7] Sin embargo, los autores también señalan que sus descubrimientos son preliminares respecto a la importancia exacta de esta emisión de metano.[8] Las medidas a largo plazo del metano por la NOAA muestran que el aumento de metano en la atmósfera ha disminuido de manera drástica, después de casi triplicarse desde la época preindustrial.[9] Se cree que esta reducción se debe a la disminución de las emisiones industriales y a la sequía en las zonas de humedales.
Liberación repentina de los clatratos de metano
A altas presiones como las que existen en el fondo del océano, el metano forma un clatrato sólido con el agua, conocido como hidrato de metano. La cantidad de metano que se encuentra atrapada con esta forma en los sedimentos oceánicos es desconocida pero posiblemente sea muy grande, del orden del billón de toneladas.
La hipótesis del "fusil de clatratos" es una teoría que sugiere que si el calentamiento global produce un aumento de la temperatura suficiente de estos depósitos, todo este metano se podría liberar repentinamente a la atmósfera. Debido a que el metano es veintitrés tres veces más potente (para el mismo peso, en un periodo de 100 años) que el dióxido de carbono como gas de efecto invernadero, amplificaría de manera inmensa el efecto invernadero, calentando la Tierra hasta niveles sin precedentes. Esta teoría serviría también para explicar la causa del rápido calentamiento global en el pasado lejano de la Tierra, como en el máximo térmico del Paleoceno-Eoceno hace 55 millones de años.
Emisión de metano desde turberas
Aunque menos dramáticas que las de los clatratos, pero ya produciéndose, es un aumento en las emisiones de metano por parte de las turberas mientras el permafrost se funde. Aunque los registros del permafrost son limitados, en años recientes (1999 y 2001) se han batido los récords de deshielo en el permafrost en Alaska y Siberia.
Las medidas recientes en Siberia también muestran que el metano liberado es cinco veces mayor que las estimaciones previas.[10]
Mecanismos de eliminación
El principal mecanismo de eliminación de metano de la atmósfera es mediante la reacción con el radical hidroxilo, el cual se forma por el bombardeo de los rayos cósmicos sobre las moléculas de vapor de agua.
- CH4+ ·OH → ·CH3+ H2O
Esta reacción en la troposfera da al metano una vida de 9,6 años. Dos sumideros más son el suelo (160 años de vida) y la pérdida estratosférica por la reacción con los elementos químicos ·OH, Cl y O (¹D) en la estratosfera (120 años vida), dando lugar a una vida neta de 8,4 años.[5]
El metano en Marte
La presencia demostrada de metano en Marte constituye todavía un misterio y es un posible signo de vida en Marte. La variación estacional de este gas en la atmósfera marciana sugiere que hay una fuente activa de origen geológico o biológico.
Syrtis Majores una de las regiones del planeta rojo donde se origina el metano.
El metano en Marte se descubrió en el año 2003 y aparece en la atmósfera marciana en una proporción de 10 partes por 1.000 millones dentro de una atmósfera que en un 95% es de dióxido de carbono.
La sonda europea Mars Express confirmó la presencia permanente de metano que dada la degradación fotoquímica que sufre, sólo se puede explicar si hay una fuente renovable de este gas.
El origen del metano marciano puede ser geológico (volcánico, aunque sin evidencias de volcanes superficiales) o biológico. En este segundo caso deberían ser microbios anaerobios que quizá podrían vivir bajo la superficie en una posible agua líquida.
Según publicó la revista Science en enero de 2009, se han empleado detectores de infrarrojos desde telescopios terrestres y se ha podido observar la evolución del metano a lo largo de tres años marcianos (equivalentes a 7 años terrestres ) y se ha visto que el metano muestra variaciones en el tiempo y acumulación en ciertas regiones.
Concretamente se ha visto que la fuente principal contenía 19.000 toneladas con una emisión por segundo de 600 gramos.
La vida media del metano en Marte es muy corta, de cuatro años terrestres, y quizás lo degradan oxidantes presentes en el polvo flotante.
Una hipótesis apunta a la presencia de microbios bajo el hielo marciano, donde la radiación podría producir hidrógeno a partir de agua líquida y el CO2proporcionar el carbono para producir finalmente metano.
El próximo rover marciano, MSL, estará equipado con sistemas para medir metano y determinar qué isótopo de carbono contiene. En caso de tratarse de carbono-12, sería biológico.
Fuentes de metano
Los orígenes principales de metano son:
- Descomposición de los residuos orgánicos por bacterias.
- Fuentes naturales (pantanos): 23%.
- Extracción de combustibles fósiles: 20% (el metano tradicionalmente se quemaba y emitía directamente. Hoy día se intenta almacenar en lo posible para reaprovecharlo formando el llamado gas natural).
- Los procesos en la digestión y defecación de animales. 17%. (Especialmente del ganado).
- Las bacterias en plantaciones de arroz: 12%.
- Digestión anaeróbica de la biomasa.
- Materia viva vegetal: (Se ha descubierto que plantas y árboles emiten grandes cantidades de gas metano).
El 60% de las emisiones en todo el mundo es de origen antropogénico. Proceden principalmente de actividades agrícolas y otras actividades humanas. La concentración de este gas en la atmósfera se ha incrementado de 0,8 a 1,7 ppm, pero se teme que lo haga mucho más a medida que se libere, al aumentar la temperatura de los océanos, el que se encuentra almacenado en el fondo del Ártico.
Son de la familia homóloga -CH2 metilenoPropiedades
Véase también
- Alcano
- Clatrato de metano
- Hidrocarburos
Referencias
- ↑ «“Existe un momento supremo en que ya no podemos fundamentar objetivamente nuestra decisión”».
- ↑ IPCC Third Assessment Report
- ↑ a b William F. Ruddiman, Libro, Madrid, 2008, pag 121
- ↑ a b «Technical summary». Climate Change 2001. United Nations Environment Programme.
- ↑ a b c «Trace Gases: Current Observations, Trends, and Budgets». Climate Change 2001. United Nations Environment Programme.
- ↑ Nature (ed.): .
- ↑ BBC (ed.): .
- ↑ eurekalert.org (ed.): .
- ↑ SCIENTISTS PINPOINT CAUSE OF SLOWING METHANE EMISSIONS
- ↑ BBC (ed.): (2006 -- 09-07).
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre MetanoCommons.
Wikimedia Commons alberga contenido multimedia sobre MetanoCommons.- Instituto nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del metano.
Categorías:- Alcanos
- Combustibles fósiles
- Gases de efecto invernadero
Wikimedia foundation. 2010.