- Cloruro de fósforo (V)
-
Pentacloruro de fósforo 
General Nombre (IUPAC) sistemático Cloruro de fósforo (V) Otros nombres Pentacloruro de fósforo Fórmula molecular PCl5 SMILES ClP(Cl)(Cl)(Cl)Cl Masa molar 208.22 g mol−1 Apariencia Cristales Incoloros CAS number [10026-13-8] Propiedades Densidad y phase 1.6 g cm−3 Solubilidad en agua Descomposición (violenta) Otros Disolventes Disulfuro de carbono,
chlorocarbons,
BencenoPunto de fusión 179–181 °C Punto de ebullición Sublimación 70-80 °C
(vacío)Estructura Geometría
analíticaBipirámide trigonal Estructura cristalina Momento dipolar 0 D Riesgos MSDS External MSDS Main hazards HCl source NFPA 704 R/S statement R: 14-22-26-34-48/20
S: 26-36/37/39-45-7/8RTECS number TB6125000 Datos suplementarios Spectral data Raman:
456 cm−1 (PCl4+)
354 cm−1 (PCl6−)
393 cm-1 (PCl5)Related compounds Compuestpos POCl3,
PCl3,
PF5Excepto que así sea indicado, los datos de los materiales
se dan en estado estándar (a 25 °C, 100 kPa)
Infobox disclaimer and referencesNFPA 704 El pentacloruro de fósforo es el compuesto químico de fórmula PCl5. Es uno de los cloruros de fósforo más importantes, siendo los otros el agente clorante. Es un sólido incoloro que reacciona con el agua y adopta múltiples estucturas bajo diversas condiciones.
Contenido
Estructura
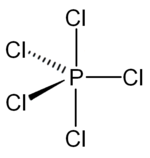
El PCl5 gaseoso y el líquido son moléculas neutras que presentan una simetría trigonal bipiramidal (D3h). Sin embargo, la estructura del “PCl5” en disolución, depende del disolvente y de la concentración.[1] En solventes polares, si la solución es diluida el compuesto se disocia de acuerdo al siguiente equilibrio:
- PCl5
 [PCl4+]Cl−
[PCl4+]Cl−
A mayores concentraciones, un segundo equilibro se hace más importante:
- 2 PCl5
 [PCl4+][PCl6−]
[PCl4+][PCl6−]
El catión PCl4+ y el anión PCl6− tienen geometría tetraédrica y octaédrica, respectivamente. Las estructuras para los cloruros de fósforo son invariablemente consistentes con la teoría TREPEV.
En disolvente apolares, como el espectroscopía de Raman.
Preparación
El PCl5 se prepara por medio de la cloración del PCl3. Esta reacción produce ca. 10,000,000 kg de PCl5 in 2000.[3]
PCl3 + Cl2
 PCl5 ΔH = −124 kJ/mol
PCl5 ΔH = −124 kJ/molEl PCl5 existe en equilibrio con el PCl3 y cloro, a 180 °C. El porcentaje de disociación es alrededor del 40%.[3] Debido a este equilibrio, las muestras de PCl5 a menudo contienen cloro lo que les confiere una coloración verdosa.
Hidrólisis
En su reacción más característica, el PCl5 reacciona al contacto con el agua para dar cloruro de hidrógeno y óxidos de fósforo. EL primer producto de la hidrólisis es el oxicloruro de fósforo
- PCl5 + H2O → POCl3 + 2 HCl
En agua caliente, la hidrólisis produce solo ácido ortofosfórico:
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Otras reacciones
A menudo, el PCl5 se usa para cloraciones.[4]
Cloraciones de compuestos orgánicos con PCl5
En química sintética, hay frecuentemente dos clases de cloración de interés. Las cloraciones oxidativas involucran la transferencia de Cl2 del reactivo al sustrato. Las cloraciones sustitivas, en cambio, reemplazan O o grupos hidroxilo (OH) con cloro. El PCl5 puede ser utilizado en ambos procesos.
PCl5 convierte los ácido carboxílicos a los correspondientes cloruros de ácido[5] así como alcoholes en cloruros de alquilo. El cloruro de tionilo es comúnmente más usado en el laboratorio porque el SO2 se separa más fácilmente de los productos orgánicos que el POCl3.
PCl5/PCl3 guarda algún parecido con el DMF, para dar cloruro de dimetilclorometilenamonio el cual es conocido como el reactivo de Vilsmeier, [(CH3)2NCClH]Cl. Más comúnmente una sal similar se genera de la reacción entre la DMF y el POCl3. Tales reactivos son útiles en la preparación de derivados del benzaldehído por formilación y conversión de los grupos C-OH en grupos C-Cl.[4]
En contraste con el PCl3, el pentacloruro reemplaza grupos CH alílicos y bencílicos y es especialmente reconocido por la conversión de grupos C=O a CCl2 groups.[6]
El carácter electrofílico del PCl5 queda de manifiesto por su reacción con el estireno para dar después de hidrólisis derivados del ácido fosfónico.[7]
Cloración de compuestos inorgánicos
Así como en las reacciones para los compuestos orgánicos, el uso del PCl5 ha sido sustituido por el SO2Cl2. La reacción del pentóxido de fósforo y el PCl5 produce dióxido de nitrógeno:
- PCl5 + 2 NO2 → PCl3 + 2 hexafluorofosfato de litio, LiPF6, un electrolito en las baterías de ion litio:
Seguridad
PCl5 es una sustancia peligrosa as reacciona violentamente con agua y es una fuente tanto de cloruro de hidrógeno como de cloro.
Véase también
- Phosphorus halides
Referencias
- ↑ Suter, R. W.; Knachel, H. C.; Petro, V. P.; Howatson, J. H.; S. G. Shore, S. G. ”Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents” Journal of the American Chemical Society 1973, volume 95, pp 1474 - 1479; DOI: 10.1021/ja00786a021
- ↑ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. ISBN 0-444-89307-5.
- ↑ a b Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ a b Burks, Jr., J. E. “Phosphorus(V) Chloride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ↑ Adams, R.; Jenkins, R. L. “p-Nitrobenzoyl chloride” Organic Syntheses, Collected Volume 1, p.394 (1941).
- ↑ Gross, H.; Rieche, A.; Höft, E.; Beyer, E. “Dichloromethyl Methyl Ether” Organic Syntheses, Collected Volume 5, p.365 (1973).
- ↑ Schmutzler, R. ”Styrylphosphonic dichloride” Organic Syntheses, Collected Voume 5, p.1005 (1973).
Categorías:- Cloruros
- Compuestos de fósforo
- PCl5
Wikimedia foundation. 2010.