- Hexafluoruro de azufre
-
Hexafluoruro de azufre
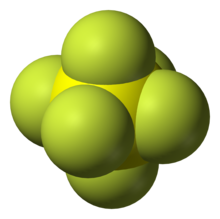
Nombre (IUPAC) sistemático Hexafluoruro de azufre General Otros nombres Elagas™, Esaflon™ Fórmula semidesarrollada SF6 Fórmula molecular n/d Identificadores Número CAS 2551-62-4 Número RTECS WS4900000 Propiedades físicas Estado de agregación Gas Apariencia Incoloro Densidad 6,164 g/l (gas, 20 °C, 1 atm) kg/m3; 1,371 g/ml (líquido, 21 °C) g/cm3 Masa molar 146 g/mol Punto de ebullición 209 K (-64,15 °C) Punto de descomposición 773 K ( °C) Temperatura crítica 318,5 K ( °C) Propiedades químicas Solubilidad en agua muy baja Momento dipolar 0 D Peligrosidad NFPA 704 Número RTECS WS4900000 Riesgos No inflamable, no tóxico Ingestión imposible Inhalación En concentraciones elevadas (más de 80%), narcosis. Mayores concentraciones pueden producir asfixia por desplazamiento de oxígeno. Piel no hay riesgo Ojos no hay riesgo LD50 5790 mg/kg (en ratas) Más información Gas muy pesado. Peligro de asfixia por fugas de gas en sótanos o lugares poco ventilados. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl hexafluoruro de azufre es un compuesto inorgánico de fórmula SF6. En condiciones normales de presión y temperatura es un gas incoloro, inodoro, no toxico y no inflamable, con la peculiaridad de ser cinco veces más pesado que el aire, presentando una densidad de 6,13 g/L a una atmósfera de presión. El SF6 presenta geometría molecular octaédrica, consistente en seis átomos de fluor enlazados a un átomo central de azufre. Es una molécula hipervalente que se encuentra en gases no polares. Es un gas muy inerte y poco soluble en agua, aunque sí en solventes orgánicos no polares (alcohol, éter).[1] También reacciona con el litio.
Es un gas causante de efecto invernadero, catalogado con un índice GWP de 176[1] (unas 20.000 veces más que el CO2),[2] pero dada su gran densidad no asciende a las capas altas de la atmósfera. Unido eso a su escasa presencia en la atmósfera, su contribución al calentamiento global es mínima.
Contenido
Síntesis
Fue descubierto en 1901 por el premio Nobel de química Henri Moissan y por Paul Lebeau, sintetizado a partir de la exposición directa de azufre (S8) y flúor gaseoso (F2) a 300ºc. En la actualidad sigue utilizándose esencialmente el mismo sistema para su fabricación industrial,[3] con el único añadido de posteriores procesos de purificación.
Características
Es un gas de elevada constante dieléctrica (muy aislante), por lo que se usa habitualmente como aislante en los sistemas de distribución de electricidad, especialmente en altos voltajes. También se aplica en algunos procesos industriales siderúrgicos,[3] y en cirugía ocular[4]
A elevadas temperaturas (más de 204 °C),[5] se descompone en sustancias tóxicas, como ácido fluorhídrico, dióxido de azufre y distintos sulfatos.[1]
Curiosidades
Este gas es conocido por afectar a la voz humana de modo opuesto al helio: al inhalar este gas, la densidad del gas provocará una vibración menor en las cuerdas vocales, haciendo que la voz suene más grave.
Otra aplicación lúdica provocada por la elevada densidad de este gas es la de hacer flotar objetos en él, dando la apariencia de que dichos objetos flotan en el aire.
El Hexafluoruro de azufre en la cultura popular
El filósofo Jonás Barnaby hace referencia al Hexafluoruro de azufre en varios ensayos, refiriéndose metafóricamente a él como una muestra de la capacidad tecnoludocrática de la mutabilidad de la consciencia-fonética humana.
Referencias
- ↑ a b c «Ficha de datos de seguridad» (PDF). Consultado el 6 de marzo de 2009.
- ↑ «Climate Change 2001» (en inglés). Consultado el 6 de marzo de 2009.
- ↑ a b «SF6 (Hexafluoruro de azufre)». Consultado el 6 de marzo de 2009.
- ↑ «Uso del hexafluoruro de azufre en la cirugía filtrante del glaucoma». Consultado el 6 de marzo de 2009.
- ↑ «Hoja de seguridad del material» (PDF). Consultado el 6 de marzo de 2009.
Enlaces externos
Wikimedia foundation. 2010.

