- Tautómero
-
Tautómeros (del griego tauto = igual y griego meros = la parte) se denominan dos isómeros que se diferencian sólo en la posición de un grupo funcional. Entre las dos formas existe un equilibrio químico. En un equilibrio tautomérico hay migración de un grupo o átomo.
Puede clasificarse en:- Desmotropía o seudomería cuando los tautómeros pueden ser aislados o no.
- Cationotropía o anionotropía cuando el grupo que migra es un catión o un anión respectivamente. El caso en que el grupo migrante sea el catión hidrógeno recibe el nombre de prototropía.
La tautomería ceto-enol
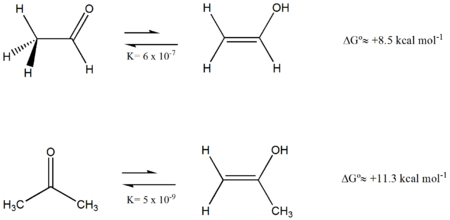
La tautomería más conocida es la tautomería ceto-enol. Los enoles (compuestos que cuentan con un grupo hidroxilo unido a un carbono con un doble enlace carbono-carbono) resultantes de la migración formal de un hidrógeno de un carbono en posición alfa a un grupo carbonilo al oxígeno del grupo carbonilo.
Generalmente se trata de un equilibrio con predominio de la forma ceto aunque la cantidad de cada forma depende de la estabilidad relativa de ambos tautómeros;[1] afectada por la capacidad de formación de puentes de hidrógeno por parte del disolvente, una posible conjugación de los dobles enlaces o la formación de un puente de hidrógeno intramolecular como en el caso de la acetilacetona que desplaza el equilibrio hacia la forma enólica.
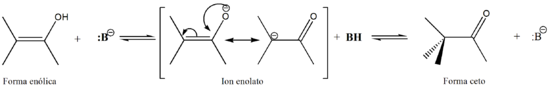
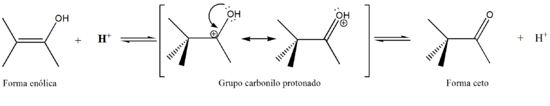
La tautomerización puede ser catalizada tanto por ácidos como por bases.[2]
En la catálisis por bases, la base extrae un hidrógeno alfa de la forma cetónica formando un anión enolato; la deslocalización de la carga y posterior protonación del anión lleva a la forma enólica, como muestra la siguiente imagen
En la catálisis por ácidos, se protona el oxígeno del grupo carbonilo. La desprotonación de un carbono alfa da la forma enolíca.A su vez, este tautomerismo nos permite reemplazar los hidrógenos con deuterio al hacer reaccionar una cetona con un ácido o una base en presencia de deuterio D2O utilizado como disolvente, proceso que puede ser seguido mediante 1H RMN y que nos da la ventaja de saber cuántos hidrógenos alfa posee la molécula en cuestión.
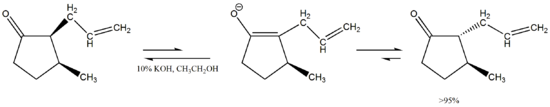
Otra característica interesante de esta tautomería es que la misma puede inducir la estereoisomerización, como nos muestra esta cis-ciclopentanona 2,3-disustiuida que se transforma en su isómero trans que se encuentra menos impedido y por lo tanto es energéticamente más favorable.
Porcentaje de la forma enol en el equilibrio para diferentes compuestos
- Propanona (=acetona) : 0,00025 %
- 2,3-Butanodiona (=diacetil ó diacetilo): 0,0056 %
- Ciclohexanona: 0,02 %
- Acetilacetona: 84,2%
Referencias
- ↑ Vollhardt, K.P. Schore, N. Química Orgánica. 3ra edición. Barcelona. Omega. 2000. pp 784 y ss. ISBN 84-282-1172-8.
- ↑ McMurry, John. Química Orgánica. 6a edición. México DF. Thomson. 2004. pp 820 y ss. ISBN 970-686-354-0
Wikimedia foundation. 2010.