- Ácido peryódico
-
Ácido peryódico
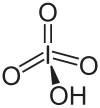
Nombre (IUPAC) sistemático Ácido peryódico General Otros nombres Ácido periódico Fórmula estructural Estructura en Jmol Fórmula molecular HIO4 Identificadores Número CAS 10450-60-9 PubChem ChemSpider 58684 ChEBI 29149 Propiedades físicas Estado de agregación Sólido Apariencia Cristales incoloros Masa molar 191.91 g/mol Punto de fusión 395 K (121,85 °C) Propiedades químicas Peligrosidad NFPA 704 Frases R R8 R34 Frases S S26 S36/37/39 S45 Riesgos Ingestión No inducir vómito, enjuagar con abundante agua, atención médica. Inhalación Extremadamente destructivo para el tejido de las membranas mucosas y tracto respiratorio superior. Dar aire fresco, respiración artificial si es necesaria, atención médica. Piel Quemaduras. Quitar ropa contaminada y zapatos inmediatamente, lavar con jabón y abundante agua, atención médica. Ojos Quemaduras. Enjuagar los ojos durante el trayecto al hospital, enjuagar cuidadosamente con abundante agua por al menos 15 minutos, atención médica. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl ácido peryódico,[1] o ácido yódico (VII) [2] es un oxácido de yodo que tiene la fórmula química HIO4 (ácido metaperyódico) o H5IO6 (ácido ortoperyódico).
En una disolución acuosa diluida, el ácido peryódico existe como los iones discretos hidronio (H3O+) y metaperyodato (IO4−). Cuando está más concentrado, se forma el ácido ortoperyódico, y se disocia en los iones hidronio y ortoperyodato IO65−. En la práctica, los iones metaperyodato y ortoperyodato coexisten en un equilibrio químico dependiente del pH:
- IO4− + 6 H2O
 IO65− + 4 H3O+
IO65− + 4 H3O+
El ácido ortoperyódico puede ser obtenido como un sólido cristalino que puede ser deshidratado a ácido metaperyódico, HIO4. Un mayor calentamiento produce pentóxido de diyodo (I2O5) y oxígeno en vez del anhídrido esperado heptóxido de diyodo; este anhídrido no aparece en la naturaleza pero puede ser formado sintéticamente.
Habiendo dos formas de ácido peryódico, se sigue que son formados dos tipos de sales de peryodato. Por ejemplo, el metaperyodato de sodio, NaIO4, puede ser sintetizado a partir de HIO4 mientras que el ortoperyodato de sodio, Na5IO6, puede ser sintetizado a partir del H5IO6. Los metaperyodatos tienen solubilidades y propiedades químicas similares a los percloratos, ya que son similares similares pero tienen un mayor tamaño de ion, aunque son menos oxidantes que los percloratos.
El ácido peryódico se utiliza en química orgánica para el análisis estructural. El ácido peryódico unirá un diol vecinal en dos aldehídos o cetonas en fragmentos. Esto puede ser útil en determinación de la estructura de los carbohidratos.
Notas y referencias
- ↑ El nombre no deriva de "período", pero sí de "iodo": ácido periódico (comparar con ácido iódico, ácido perclórico).
- ↑ Alan Isaacs, John Daintith, Elizabeth Martin, ed (1984). Concise Science Dictionary. Oxford: Oxford University Press. pp. 356. ISBN 0192115936.
Enlaces externos
Categorías:- Peryodatos
- Ácidos
- Agentes oxidantes
- Oxácidos
- IO4− + 6 H2O
Wikimedia foundation. 2010.