- Oxidación de alcoholes
-
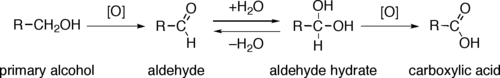 Mecanismo de oxidación de alcoholes primarios a ácidos carboxílicos a través de aldehídos y de hidratos de aldehído.
Mecanismo de oxidación de alcoholes primarios a ácidos carboxílicos a través de aldehídos y de hidratos de aldehído.
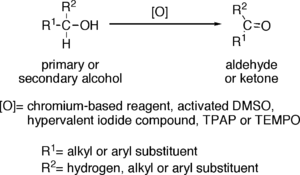
La oxidación de alcoholes es una reacción orgánica importante. Los alcoholes primarios (R-CH2-OH) pueden ser oxidados a aldehídos (R-CHO) o ácidos carboxílicos (R-COOH), mientras que la oxidación de alcoholes secundarios (R1R2CH-OH), normalmente termina formando cetonas (R1R2C=O). Los alcoholes terciarios (R1R2R3C-OH) son resistentes a la oxidación.[1]
La oxidación directa de los alcoholes primarios a ácidos carboxílicos normalmente transcurre a través del correspondiente aldehído, que luego se transforma por reacción con agua en un hidrato de aldehído (R-CH(OH)2), antes de que pueda ser oxidado a ácido carboxílico.
A menudo es posible interrumpir la oxidación de un alcohol primario en el nivel de aldehído mediante la realización de la reacción en ausencia de agua, de modo que no se puedan formar hidratos de aldehído.
Contenido
Oxidación de alcoholes a aldehídos
Los reactivos útiles para la transformación de alcoholes primarios en aldehídos normalmente también son adecuados para la oxidación de alcoholes secundarios en cetonas. Estos incluyen:
- Reactivos a base de cromo, tales como reactivo de Collins (CrO3·Py2; donde Py= piridina), PDC o PCC.
- DMSO activado, que resulta de la reacción de DMSO con electrófilos, como el cloruro de oxalilo (oxidación de Swern), una carbodiimida (oxidación de Pfitzner-Moffatt) o el complejo SO3·Py ( oxidación de Parikh-Doering).
- Compuestos de yodo hipervalente, como peryodinano de Dess-Martin o el ácido 2-yodoxibenzoico (ácido IBX).
- TPAP catalítico en presencia de un exceso de NMO (oxidación de Ley).
- TEMPO Catalítico en presencia de exceso de lejía (NaOCl) (oxidación de Anelli).
Los alcoholes alílicos y bencílicos pueden ser oxidados en presencia de otros alcoholes con ciertos oxidantes selectivos, tales como dióxido de manganeso (MnO2).
Oxidación de alcoholes a cetonas
Entre los reactivos útiles para la oxidación de alcoholes secundarios a cetonas, pero por lo general ineficaces para la oxidación de alcoholes primarios a aldehídos, se incluyen el trióxido de cromo (CrO3) en una mezcla de ácido sulfúrico y acetona (oxidación de Jones), y ciertas cetonas, como por ejemplo la ciclohexanona, en presencia de isopropóxido de aluminio (oxidación de Oppenauer). Otro método es la oxidación catalizada por oxoamonio.
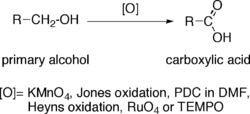
Oxidación de alcoholes a ácidos carboxílicos
La oxidación directa de los alcoholes primarios a ácidos carboxílicos puede llevarse a cabo mediante:
- Permanganato de potasio (KMnO4).
- Oxidación de Jones.
- PDC en DMF.
- Oxidación de Heyns.
- Tetróxido de rutenio (RuO4).
- TEMPO.
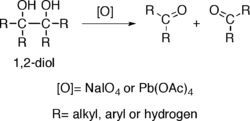
Oxidación a dioles
Los alcoholes que poseen dos grupos hidroxi situados en carbonos adyacentes, es decir, los 1,2-dioles, sufren la rotura oxidativa de un enlace carbono-carbono con algunos oxidantes como el peryodato de sodio (NaIO4) o el tetraacetato de plomo (Pb(OAc)4), propiciando la generación de dos grupos carbonilo. La reacción también es conocida como ruptura del glicol.[2]
Referencias
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3ª ed.), Nueva York: Wiley, ISBN 0-471-85472-7
- ↑ http://books.google.es/books?id=KpTfbF6mguAC&pg=PA301 Química orgánica fundamental. Louis Frederick Fieser, Mary Fieser. 4ª edición. Editorial Reverté, 1976. ISBN: 8429171614. Pág. 301
Categoría:- Reacciones orgánicas
Wikimedia foundation. 2010.