- Óxido de plata
-
Óxido de plata
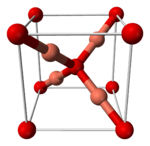
Nombre (IUPAC) sistemático óxido de plata (I) General Fórmula semidesarrollada Ag2O Fórmula molecular n/d Identificadores Número CAS 20667-12-3 Propiedades físicas Apariencia Cristales cúbicos negros o cafés oscuros Densidad 7.140 kg/m3; 7.14 g/cm3 Masa molar 231.735 g/mol Punto de fusión 550 K (280 °C) Estructura cristalina cúbico Propiedades químicas Solubilidad en agua 0.000025 g/ml[1] Solubilidad en metanol Soluble en ácido y álcali.
Insoluble en alcohol y etanol.[1]KPS 1.52 × 10-8 (20 °C) Termoquímica ΔfH0sólido -31.1 kJ/mol Calor específico 65.9[2] cal/g Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl óxido de plata (I) es el compuesto químico de la fórmula Ag2O. Es un fino polvo negro o café oscuro, usado para preparar otros compuestos de plata.
Contenido
Preparación
El óxido de plata es comercialmente disponible. Puede ser fácilmente preparado combinando soluciones acuosas de nitrato de plata y un hidróxido alcalino.[3] Cabe destacar el hecho de que esta reacción no aporta una cantidad apreciable de hidróxido de plata debido al los energéticos favorables para la siguiente reacción:[4]
Estructura y propiedades
Al igual que la mayoría de los óxidos binarios, el Ag2O es un polímero tridimensional con un enlace covalente uniendo el metal con el óxido. Es isoestructural con el Cu2O, es decir que comparten la misma estructura, por lo cual se espera que el Ag2O sea insoluble en todos los solventes,[6] excepto mediante una reacción. Además es evidente que es soluble en soluciones acuosas debido a la formación del ion Ag(OH)2– y posiblemente se relaciona con productos de hidrólisis.[7] Se disuelve en una solución de hidróxido de amonio produciendo derivados solubles.
Un compuesto acuoso de Ag2O es inmediatamente atacada por ácidos:
- Ag2O + 2 HX → 2 AgX + H2O
Donde HX es igual a HF, HCl, HBr, HI o cloruro de plata, dejando una solución al correspondiente hidróxido alcalino.[8] [7] El óxido de plata es fotosensible, y se descompone a temperaturas debajo de los 280 °C.[6]
Aplicaciones
Comercialmente, el óxido de plata se usa en las baterías de óxido de plata. En química orgánica es usado como un leve agente oxidante, por ejemplo, oxida aldehídoss en ácidos caboxílicos. Tales reacciones con frecuencia funcionan mejor si el óxido de plata es preparado in situ a partir de nitrato de plata e hidróxido alcalino.
Referencias
- ↑ a b Lide, David R. (1998). Handbook of Chemistry and Physics (87 edición). Boca Raton, FL: CRC Press. pp. 4–83. ISBN 0-8493-0594-2.
- ↑ Lide, David R. (1998). Handbook of Chemistry and Physics (87 edición). Boca Raton, FL: CRC Press. pp. 5–5. ISBN 0-8493-0594-2.
- ↑ Janssen, D. E.; Wilson, C. V. (1963). "4-Iodoveratrole". Org. Synth.; Coll. Vol. 4: 547.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Biedermann, George; Sillén, Lars Gunnar (1960). «Studies on the Hydrolysis of Metal Ions. Part 30. A Critical Survey of the Solubility Equilibria of Ag2O». Acta Chemica Scandinavica 14: pp. 717. doi:.
- ↑ a b Merck Index of Chemicals and Drugs, 14th ed. monograph 8521
- ↑ a b Cotton, F. Albert; Wilkinson, Geoffrey (1966). Advanced Inorganic Chemistry (2nd Ed.). New York:Interscience. p. 1042.
- ↑ General Chemistry by Linus Pauling, 1970 Dover ed. p703-704
Categorías:- Compuestos de plata
- Óxidos
Wikimedia foundation. 2010.

