- Plata (I)
-
La plata (I) es el estado de oxidación más frecuente en el que se encuentra la plata en los compuestos químicos. En soluciones ácidas o neutras es posible encontrar el catión Ag+; el cual, debido a la estabilidad de su configuración electrónica ([ Kr ] 4d10) que impide transiciones electrónicas en longitudes de onda del espectro visible, es incoloro.[1]
Comportamiento ácido-base
El catión Ag+ es poco ácido encontrandose solvatado en solución acuosa aún en pH débilmente alcalino (pH≈7,5). A pH mayores precipita el hidróxido de plata (AgOH), el cual se transforma expontáneamente en óxido de plata (Ag2O) más estable e insoluble.[1]
El óxido de plata no es apreciablemente soluble al aumentar el pH de la solución, si bién en soluciones altamente alcalinas parte del precipitado se disuelve por formación del anión argentito (AgO-).[1]
-
- Ag2O ↓+ 2OH- → 2AgO- + H2O
Reacciones
Reacciones de precipitación
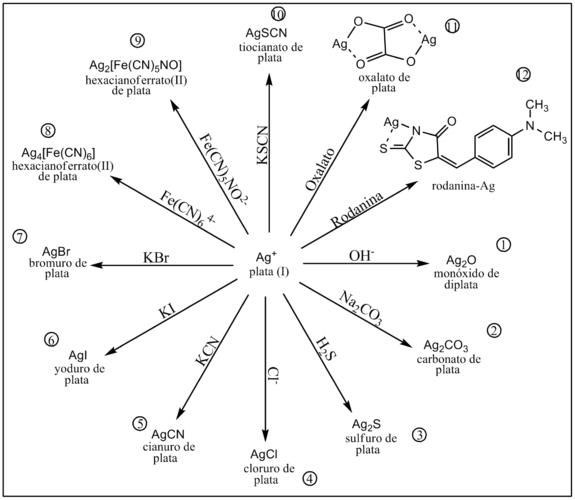
El catión Ag+ forma compuestos estables con un gran número de aniones, algunos de ellos son coloreados. Esta propiedad es utilizada para su identificación y cuantificación analítica.
1) Hidróxidos alcalinos fuertes
La alcalinización con hidróxidos alcalinos fuertes como el NaOH produce la precipitación del óxido de plata de color pardo.[1]
-
- 2 Ag+ + 2OH- → Ag2O ↓ + H2O
2) Carbonato de sodio
Por reacción con carbonato de sodio el frio se precipita carbonato de plata de color blanco.[1]
-
- 2 Ag+ + CO32- → Ag2CO3 ↓
pksAg2CO3 = 11,09 [3]
3) Ácido sulfhídrico
Por reacción con ácido sulfhídrico precipita sulfuro de plata de color negro.[1]
-
- 2 Ag+ + H2S → Ag2S ↓ + 2H+
4) Cloruros
En presencia de cloruro en medio ácido se produce un precipitado blanco de cloruro de plata.[1]
-
- Ag+ + Cl- → AgCl ↓
pksAgCl = 9,74 [3]
5) Cianuro de potasio
Por reacción con cianuros se produce la precipitación de cianuro de plata de color blanco.
-
- Ag+ + CN- → AgCN ↓
pksAgCN = 15,66 [3]
6) Yoduro de potasio
Por reacción con el anión yoduro se produce un precipitado amarillo claro de yoduro de plata.[1]
-
- Ag+ + I- → AgI ↓
pksAgI = 16,08 [3]
7) Bromuro de potasio
Por reacción con el anión bromuro se produce un precipitado amarillo claro de bromuro de plata.[1]
-
- Ag+ + Br- → AgBr ↓
pksAgBr = 12,30 [3]
8) Hexacianoferrato(II)
En presencia del anión complejo hexacianoferrato(II) se produce un precipitado altamente insoluble de hexacianoferrato(II) de plata.[1]
-
- 4 Ag+ + Fe(CN)64- → Ag4[Fe(CN)6] ↓
pksAg4[Fe(CN)6] = 44,07 [3]
9) Nitropentacianoferrato(II)
En presencia del anión complejo nitropentacianoferrato(II) se produce un precipitado altamente insoluble de nitropentacianoferrato(II) de plata.[1]
-
- 2 Ag+ + Fe(CN)5NO2- → Ag2[Fe(CN)5NO] ↓
pksAg2[Fe(CN)5NO] = 12,1 [2]
10) Tiocianato de potasio
En presencia de tiocianato precipita tiocianato de plata.[1]
-
- Ag+ + SCN- → AgSCN ↓
pksAgSCN = 11,97 [3]
11) Oxalato
En presencia de oxalato precipita oxalato de plata.[1]
-
- 2Ag+ + C2O42- → Ag2C2O4 ↓
pksAg2C2O4 = 11,0 [2]
12) Rodanina
El catión Ag+ reacciona con la rodanina, en medio débilmente ácido, produciendo un quelato color rojizo-violáceo. Esta reacción es utilizada para identificar pequeñas cantidades del catión en una muestra.[1]
14) Sulfito de sodio
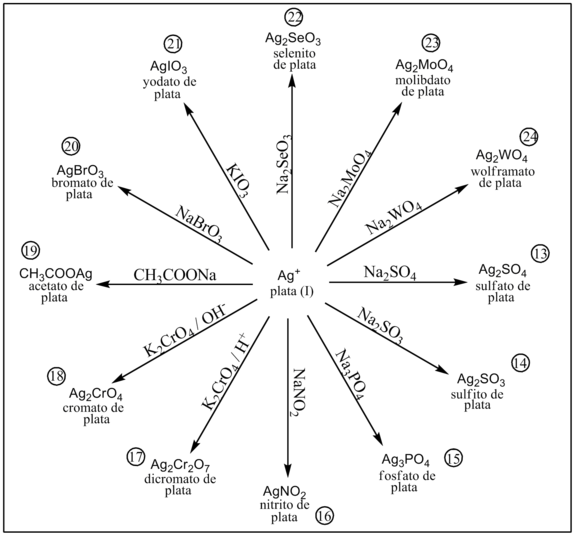
En presencia de sulfito precipita sulfito de plata.[1]
-
- 2 Ag+ + SO32- → Ag2SO3 ↓
pksAg2SO3 = 13,8 [2]
15) Fosfato de sodio
En presencia de fosfato precipita fosfato de plata.[1]
-
- 3 Ag+ + PO43- → Ag3PO4 ↓
pksAg3PO4 = 17,55 [3]
16) Nitrito de sodio
En presencia de nitrito precipita nitrito de plata.[1]
-
- 3 Ag+ + NO2- → AgNO2 ↓
pksAgNO2 = 4,1 [2]
17) Cromato de potasio en medio ácido
Por reacción con el anión dicromato se obtiene un precipitado de dicromato de plata.[1]
-
- 2 Ag+ + Cr2O72- → Ag2Cr2O7 ↓
pksAg2Cr2O7 = 6,7 [2]
18) Cromato de potasio en medio alcalino
Por reacción con el anión cromato se obtiene un precipitado rojo de cromato de plata.[1]
-
- 2Ag+ + CrO42- → Ag2CrO4 ↓
pksAg2CrO4 = 11,92 [3]
19) Acetato de sodio
En presencia de acetato se obtiene un precipitado moderadamente soluble de acetato de plata.[1]
-
- Ag+ + CH3COO- → CH3COOAg ↓
pksCH3COOAg = 2,7 [2]
20) Bromato de sodio
En presencia de bromato precipita bromato de plata.[1]
-
- Ag+ + BrO3- → AgBrO3 ↓
pksAgBrO3 = 4,26 [3]
21) Yodato de potasio
En presencia de yodato precipita yodato de plata.[1]
-
- Ag+ + IO3- → AgIO3 ↓
pksAgIO3 = 7,51 [3]
22) Selenito de sodio
En presencia de selenito precipita selenito de plata.[1]
-
- 2 Ag+ + SeO32- → Ag2SeO3 ↓
pksAg2SeO3 = 15,5 [2]
23) Molibdato de sodio
En presencia de molibdato precipita molibdato de plata.[1]
-
- 2 Ag+ + MoO42- → Ag2MoO4 ↓
pksAg2MoO4 = 11,6 [2]
24) Wolframato de sodio
En presencia de wolframato precipita wolframato de plata.[1]
-
- 2Ag+ + WO42- → Ag2WO4 ↓
pksAg2WO4 = 11,3 [2]
25) Arseniato de sodio
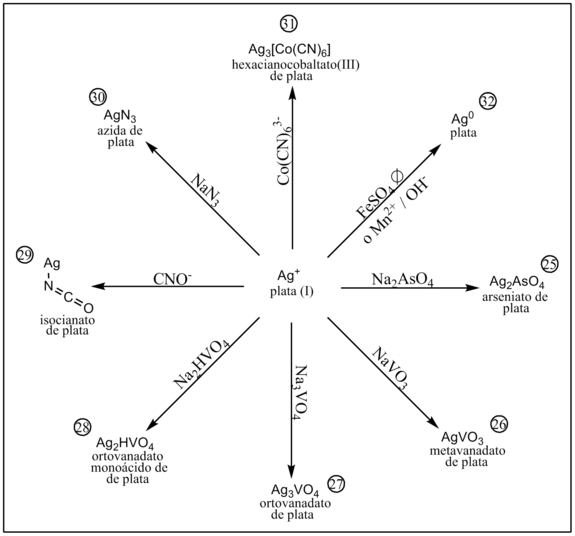
En presencia de arseniato precipita arseniato de plata.[1]
-
- 3Ag+ + AsO43- → Ag3AsO4 ↓
pksAg3AsO4 = 22,0 [2]
26) Metavanadato de sodio
En presencia de metavanadato precipita metavanadato de plata.[1]
-
- Ag+ + VO3- → AgVO3 ↓
pksAgVO3 = 6,3 [2]
27) Ortovanadato de sodio
En presencia de ortovanadato precipita ortovanadato de plata.[1]
-
- 3 Ag+ + VO43- → Ag3VO4 ↓
pksAg2VO4 = 24 [2]
28) Ortovanadato monoácido de sodio
En presencia de ortovanadato monoácido precipita ortovanadato monoácido de plata.[1]
-
- 2 Ag+ + HVO42- → Ag2HVO4 ↓
pksAg2HVO4 = 13,7 [2]
29) Isocianato
En presencia de isocianato precipita isocianato de plata.[1]
-
- Ag+ + CNO- → AgCNO ↓
pksAgCNO = 6,6 [2]
30) Azida de sodio
En presencia de azida precipita azida de plata.[1]
-
- Ag+ + N3- → AgN3 ↓
pksAgN3 = 8,56 [3]
31) Hexacianocobaltato(III) de sodio
En presencia de hexacianocobaltato(III) precipita hexacianocobaltato(III) de plata.[1]
-
- 3 Ag+ + Co(CN)63- → Ag3[Co(CN)6] ↓
pksAg3[Co(CN)6] = 25,41 [3]
32) Reductores
El cation Ag+ es reducido fácilmente a Ag0 por reductores como el sulfato ferroso (en medio neutro a ebullición) o el catión manganeso (II) en medio alcalino.[1]
-
- 2 Ag+ + Mn2+ + 4 OH- → 2 Ag0 + MnO2 + 2 H2O
Reacciones de formación de complejos
1) Amoníaco
En medio amonical se forma el catión complejo diaminoplata(I).
log β1 = 3,31; log β2 = 7,23 [3]
La formación del complejo solubiliza el cloruro de plata.[4]
2) Cianuro de potasio
En exceso de reactivo el cianuro de plata se disuelve formando el anión complejo altamente estable dicianoargentato(I).[5] [1]
-
- AgCN ↓ + CN- → Ag(CN)2-
log β2 = 20,5 [2]
3) 1,10-fenantrolina
El catión plata (I) forma con la 1,10-fenantrolina dos complejos diferentes dependiendo de su concentración en el medio.
log β1 = 5,02*; log β2 = 12,07* [3]
Condiciones físico-químicas de las constantes
- Si no se indica lo contrario, se considera 25ºC y medios con fuerza iónica nula (μ = 0).
- (*) Temperatura 25ºC y μ = 0,1.
Véase también
- Plata (II)
- Plata (III)
- Plata (IV)
Referencias
- ↑ a b c d e f g h i j k l m n ñ o p q r s t u v w x y z aa ab ac ad ae af ag F. Burriel Martí, F. Lucena Conde, S. Arribas Jimeno, J. Hernández Méndez (2006). «Química analítica de los cationes: Plata». Química analítica cualitativa (18ª edición edición). Thomson. pp. 419-426. ISBN 84-9732-140-5.
- ↑ a b c d e f g h i j k l m n ñ o p F. Burriel Martí, F. Lucena Conde, S. Arribas Jimeno, J. Hernández Méndez (2006). «Apéndice VI - Constantes de equilibrio ácido base, productos de solubilidad y constantes de formación de complejos.». Química analítica cualitativa (18ª edición edición). Thomson. pp. 1014-1032. ISBN 84-9732-140-5.
- ↑ a b c d e f g h i j k l m n ñ o Harris, Daniel C. (2007). «Apéndice F - Productos de solubilidad». Análisis químico cuantitativo (tercera edición). Reverté. pp. AP10-AP11. ISBN 84-291-7224-6.
- ↑ Sharpe, Alan G. (1993). «La química inorgánica en medios acuosos». Química inorgánica. Reverté. pp. 189-224. ISBN 84-291-7120-7.
- ↑ Chang, Raymond (2002). «La química de los metales de transición y los compuestos de coordinación». Química. Mc Graw Hill. pp. 877-908. ISBN 970-10-3894-0.
-
Wikimedia foundation. 2010.