- Oxígeno triplete
-
 Especies reactivas del oxígeno:
Especies reactivas del oxígeno:
1: oxígeno triplete
2: oxígeno singlete
3: radical anión superóxido
: peróxido de hidrógeno
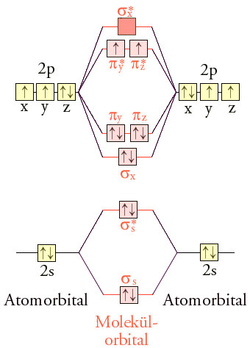
5: radical hidroxilo.El oxígeno triplete es el estado fundamental del oxígeno molecular, O2. La configuración electrónica de la molécula tiene dos electrones desapareados[1] ocupando dos orbitales moleculares degenerados. Estos orbitales se clasifican como antienlazantes, por lo que el enlace OO en el O2es más débil que el enlace de la molécula de NN en el nitrógeno N2, donde todos los orbitales moleculares enlazantes están llenos.[2]
Contenido
Espín de la molécula
Los electrones desapareados en orbitales degenerados pueden tener el mismo espín, por lo que el espín total S de la molécula es 1. Esto se conoce como una configuración triplete debido a que el espín tiene tres alineaciones posibles en un campo magnético externo.
Debido a que la molécula tiene un momento magnético de espín no nulo, el oxígeno es paramagnético, es decir, puede ser atraído por los polos de un imán. La estructura de Lewis O = O no representa con exactitud la naturaleza dirradical (radical doble) del oxígeno molecular; la teoría de orbitales moleculares se debe utilizar para explicar adecuadamente los electrones desapareados.[3]
Consecuencias sobre la reactividad
Esta configuración electrónica inusual evita que el oxígeno molecular (estado triplete) reaccione directamente con otras muchas moléculas, como a menudo ocurre con el oxígeno singlete.[4] El oxígeno triplete, sin embargo, reaccionará fácilmente con moléculas en estado doblete, tales como los radicales, para formar un nuevo radical. La conservación del número cuántico de espín requeriría un estado de transición triplete en una reacción de oxígeno triplete con capa cerrada (una molécula en un estado singlete). La energía adicional que se requiere es suficiente para evitar la reacción directa a temperatura ambiente con todos los sustratos, excepto los más reactivos, como por ejemplo, el fósforo blanco. A temperaturas más altas o en presencia de catalizadores adecuados, la reacción transcurre más fácilmente. Por ejemplo, las sustancias más inflamables se caracterizan por una temperatura de autoignición, a la que sufrirán combustión en el aire, sin la ayuda de una llama o una chispa externa.
El oxígeno singlete, donde los espines de los electrones son opuestos en un estado de mayor energía, es mucho más reactivo que el oxígeno triplete, y extremadamente peligroso para la materia orgánica por lo que se utiliza para el exterminio de las infecciones graves de plagas persistentes en las casas y edificios.
Véase también
- Oxígeno singlete, O2* (estado excitado)
- Trioxígeno (Ozono), O3
- Tetraoxígeno, O4
- Octaoxígeno, O8
Referencias
- ↑ Bases fisiológicas del envejecimiento y geriatría. Paola S. Timiras. Elsevier España, 1997. ISBN: 8445803662. Pág. 76
- ↑ Estresse Oxidativo E Antioxidantes. Norma Possa Marroni (organiz.) Editora da ULBRA. ISBN: 8575280457. Pág. 23
- ↑ Enología: fundamentos científicos y tecnológicos. Claude Flanzy. Mundi-Prensa Libros, 2003. ISBN: 848476074X. Pág. 374
- ↑ Química inorgánica. Alan G. Sharpe. Editorial Reverté, 1996. ISBN: 8429175016. Pág. 424
- Reacciones del oxígeno atómico triplete con compuestos orgánicos: estudio cinético por quimiluminiscencia con reactor de flujo rápido de gases. Francisco Luis Tabarés Vázquez (tesis doctoral). Facultad de Ciencias Químicas. Universidad Complutense de Madrid. 1983.
Enlaces externos
Categorías:- Oxígeno
- Fisicoquímica
- Radicales
Wikimedia foundation. 2010.