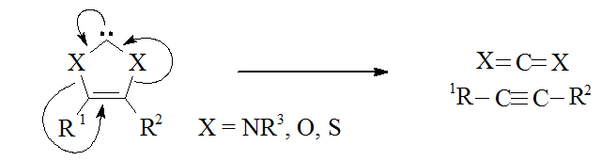- Carbeno persistente
-
Carbeno persistente
Un carbeno persistente (también conocido como carbeno estable o carbeno Arduengo) es un tipo de carbeno que demuestra estabilidad particular, a pesar de ser también un intermediario reactivo. La inestabilidad en estos carbonos involucra reactividad con sustratos, o dimerización (ver equilibrio de Wanzlick). Los carbenos persistentes pueden existir en el estado singulete o el estado triplete, siendo el estado singulete el más estable.
El campo de la investigación de los carbenos estables fue iniciado en 1988 por el grupo de investigación de Guy Bertrand con el aislamiento de un carbeno de fosfinosililo estable. Alentados por los resultados en el grupo de Bertrand y el subsiguiente trabajo seminal de Wanzlick sobre diaminocarbenos cíclicos estables, el grupo de Arduengo produjo un carbeno cristalino.[1]
En abril del 2009, la revista internacional de química Angewandte Chemie reportó que científicos singapurenses del Institute of Bioengineering and Nanotechnology consiguieron producir metanol a partir de una combinación de carbeno N-heterocíclico, dióxido de carbono, dióxido de silicio, e hidrógeno, bajo condiciones moderadas en aire seco[2]
Sin embargo, previo a este aislamiento, la existencia de los carbenos persistentes había sido propuesta por Ronald Breslow en 1957.[3] [4] El grupo Hans-Werner Wanzlick[5] [6] fue el primer grupo en preparar (mas no aislar) un carbeno estable. En 1989, el grupo de Guy Bertrad[7] [8] fue el primero en preparar y aislar un carbeno estable.
Típicamente, los carbenos normales son moléculas muy reactivas de vida corta, que no pueden ser aisladas, y usualmente son estudiadas observando las reacciones en las que intervienen. Sin embargo, los carbenos persistentes son mucho más estables, y tienen una vida considerablemente mayor. Esto significa que, en muchos casos, estos carbenos son termodinámicamente estables en la ausencia de humedad y (en la mayoría de casos) oxígeno, y pueden ser aislados y almacenados indefinidamente. Algunos carbenos persistentes no son termodinámicamente estables y se dimerizan lentamente con el transcurrir de los días. Los carbenos menos estables de estado triplete tienen vida media medida en segundos, y no pueden ser almacenados, sino sólo observados.
Contenido
Clases de carbenos estables
Los siguientes son ejemplos de las clases de carbenos estables aislados a la fecha:
Imidazol-2-ilidenos
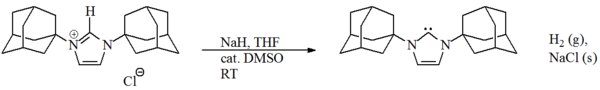
Los imidazol-2-ilidenos fueron la primera (y la más estable) familia de carbenos estables aislados, y de ahí que sean los mejor estudiados y comprendidos. Ha sido sintetizado un rango considerable de imidazol-2-ilidenos, incluyendo aquellos en los que las posiciones 1,3 han sido funcionalizadas con alquilo, arilo,[9] alquiloxi, alquilamino, alquilfosfino,[10] e incluso sustituyentes quirales:[10]
Es argüible que una de las funcionalizaciones más interesantes ocurrió con la dicloración 4,5 del medio imidazol, resultando en un carbeno estable al aire.[11] También han sido sintetizadas moléculas que contienen dos, e incluso tres, imidazol-2-ilidenos.[12] [13]
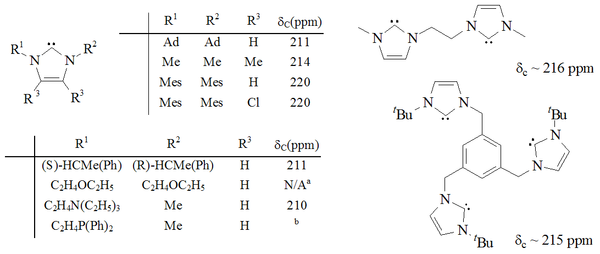
Los imidazol-2-ilidenos han sido preparados por la deprotonación de las sales de imidazol, y por la desulfuración de tioureas con potasio fundido. Los carbenos basados en imidazol son termodinámicamente estables y generalmente tienen valores diagnósticos de corrimiento químico NMR 13C entre 210 y 230 ppm para el carbono carbénico. Típicamente, las estructuras de rayos X de estas moléculas muestran ángulos de enlace N-C-N cercanos a 101° - 102°.
Triazol-5-ilidenos
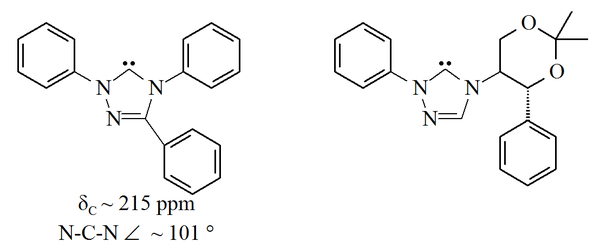
Los triazol-5-ilidenos mostrados abajo fueron preparados primero por Enders y colaboradores[14] por pirólisis al vacío a través de pérdida de metanol de los 2-metoxitriazoles. Sólo ha sido reportado un rango limitado de estas moléculas con la molécula de trifenilo sustituida comercialmente disponible.
Los carbenos basados en triazol son termodinámicamente estables y tienen valores de corrimientos químicos NMR diagnosticados entre 210-220 ppm para el carbono carbénico. La estructura de rayos X del carbeno sustituido trifenilo mostrado arriba muestra un ángulo de enlace N-C-N cercano a 101°. El precursor de 5-metoxitriazol a este carbeno fue preparado por tratamiento de una sal de triazolio con metóxido de sodio, que ataca como un nucleófilo.[14] Esto puede indicar que estos carbenos son menos aromáticos que los imidazol-2-ilidenos, puesto que los precursores de imidazolio no reaccionan con nucleófilos debido a la inherente pérdida de aromaticidad.
Diaminocarbenos cíclicos y acíclicos
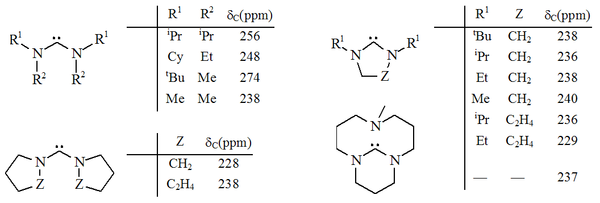
Ha sido preparado un rango de diaminocarbenos cíclicos, principalmente por el grupo de investigación de Roger Alder, en el que la unidad N-C-N es un miembro de un anillo de 5 o 6 miembros,[15] [16] [17] incluyendo un ejemplo bicíclico. El grupo de Alder ha preparado una diversidad de diaminocarbenos acíclicos.[18] [19] [20]
A diferencia de los imidazol-2-ilidenos o triazol-5-ilidenos aromáticos, estos carbenos parecen no ser termodinámicamente estables, como lo muestra la dimerización de algunos ejemplos no impedidos estéricamente, tanto cíclicos como acíclicos.[16] [19] Sin embargo, el trabajo más reciente de Alder[21] sugiere que estos carbenos se dimerizan vía dimerización catalizada por ácido (ver carbeno persistente#equilibrio de Wanzlick|equilibrio de Wanzlick]]). Los carbenos dihidroimidazol fueron preparados por medio de la desulfurización de tioureas con potasio fundido[16] deprotonación de las sales de dihidroimidazolio respectivas. Los carbenos acíclicos[18] [19] y los carbenos basados en el tetrahidropirimidinilo[17] fueron preparados por deprotonación usando bases homogéneas fuertes. Los diaminocarbenos tienen valores de corrimiento químico 13C NMR diagnosticado entre 230 y 270 ppm para el carbono carbénico. La estructura de rayos X del carbeno de dihidroimidazolo muestra un ángulo de enlace N-C-N cercano a 106°, mientras que el ángulo del carbeno acíclico es 121°, ambos mayores que los vistos para los imidazol-2-ilidenos.
Heteroaminocarbenos
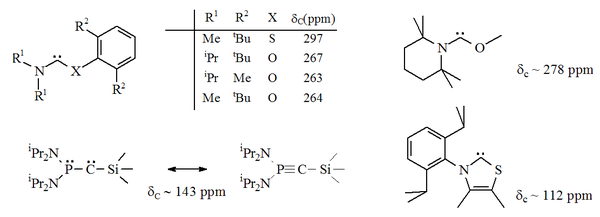
Han sido preparados carbenos estables nucleofílicos en los que uno de los átomos de nitrógeno adyacentes al centro carbeno ha sido reemplazado por un heteroátomo alternativo (por ejemplo: O, S, o P)[22] [23] [7] [8] , así como especies en las que ambos átomos de nitrógeno han sido reemplazados por átomos de fósforo.[24] Sin embargo, stos "carbenos" sustituidos con fósforo muestran algunas propiedades alquínicas, y cuando se publicó, la naturaleza carbénica exacta de estos aceites rojos estaba en debate.[8]
Un heteroamino aromático basado en tiazol (análogo al carbeno postulado por Breslow)[25] ha sido preparado y caracterizado por cristalografía de rayos X.[22] Otros carbenos formalmente aromáticos sustituidos en α por un heteroátomo talvez han sido sintetizados, dado que tienen el potencial de disociarse en alquinos (esto es: R'CCR, así como X=C=X). La reacción del disulfuro de carbono con acetilenos deficientes en electrones produce carbenos transientes 1,3-ditiolio (por ejemplo, donde X = S) que se dimerizan luego. Entonces es posible que el reverso de este proceso pueda ocurrir en carbenos similares.[26]
Han sido caracterizados por cristalografía de rayos X carbenos acíclicos no aromáticos con átomos de O, S, y P adyacentes (en alfa) al centro carbeno, carbenos basados en tio- y oxi-iminio.[23]
Dado que el oxígeno y el azufre son divalentes, la protección estérica del centro carbeno es limitada, especialmente cuando la unidad N-C-X es parte de un anillo. Estos carbenos acíclicos tienen valores diagnosticados de corrimiento químico 13C NMR entre 250-300 ppm para el carbono carbénico, mucho más campo arriba que los otros tipos de carbenos estables. Las estructuras de rayos X han mostrado ángulos de enlace N-C-X cercanos a 104° y 109°, respectivamente.
Otros carbenos nucleofílicos
Un carbeno estable N-heterocíclico[27] tiene una estructura análoga a la borazina, con un átomo de boro reemplazado por el metileno. Esto resulta en un compuesto planar de 6 electrones.
-
Archivo:Borazine carbene.gifEn el segundo paso de esta secuencia de reacciones, el protón es abstraído por LiTMP, dos grupos ciclohexilo apantallan al carbeno.
Carbenos de estado triplete
En el 2001, Hideo Tomioka y sus asociados fueron capaces de producir un carbeno triplete comparativamente estable, tomando ventaja de la resonancia. El bis(9-antril)carbeno triplete tiene una vida media de 19 minutos.[28] [29]
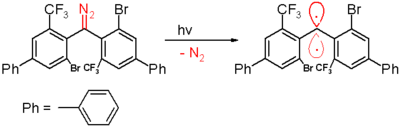
En el 2006, el mismo grupo reportó un carbeno triplete con una vida media de 40 minutos.[30] Este carbeno es preparado por descomposición fotoquímica de un diazometano, con expulsión de gas dinitrógeno a una longitud de onda de 300 nm, en benceno. Como con los otros carbenos, esta especie contiene sustituyentes muy voluminosos, en esta molécula los grupos bromo y trifluorometilo, que apantallan al carbeno y evitan o ralentizan el proceso de dimerización a 1,1,2,2-tetra(fenil)alqueno. Los experimentos in silico muestran que la distancia del átomo de carbono divalente a sus vecinos es 138 pm, con un ángulo de enlace de 158,8°. El ángulo diedro es 85,7°, lo que hace a los grupos fenilo estar a casi ángulo recto entre sí. La exposición a oxígeno (diradical) convierte el carbeno a la correspondiente benzofenona y el compuesto difenilmetano es formado cuando es atrapado por 1,4-ciclohexadieno.
Referencias
- ↑ A. J. Arduengo, R. L. Harlow and M. Kline (1991). «A stable crystalline carbene» J. Am. Chem. Soc.. Vol. 113. n.º 1. pp. 361–363. DOI 10.1021/ja00001a054.
- ↑ «Ground-breaking research finds way to convert CO2 into clean-burning biofuel», April 2009. Consultado el 2009-08-01.
- ↑ Ronald Breslow (1957). «Mechanism of Thiamine Action: Participation of a Thiazolium Zwitterion» Chemistry and Industry. Vol. 26. pp. 893.
- ↑ R. Breslow (1957). «Rapid Deuterium Exchange in Thiazolium Salts» Journal of the American Chemical Society. Vol. 79. n.º 7. pp. 1762–1763. DOI 10.1021/ja01564a064.
- ↑ Hans-Werner Wanzlick and E. Schikora (1960). «Ein neuer Zugang zur Carben-Chemie» Angewandte Chemie. Vol. 72. n.º 14. pp. 494. DOI 10.1002/ange.19600721409.
- ↑ H. W. Wanzlick and E. Schikora (1960). «Ein nucleophiles Carben» Chemische Berichte. Vol. 94. n.º 9. pp. 2389–2393. DOI 10.1002/cber.19610940905.
- ↑ a b A. Igau, H. Grutzmacher, A. Baceiredo, G. Bertrand (1988). «Analogous α,α'-bis-carbenoid, triply bonded species: synthesis of a stable λ3-phosphino carbene-λ3-phosphaacetylene» J. Am. Chem. Soc.. Vol. 110. pp. 6463–6466. DOI 10.1021/ja00227a028.
- ↑ a b c G. Bertrand, R. Reed (1994). «λ3-Phosphinocarbenes λ5-phosphaacetylenes» Coordination Chemistry Reviews. Vol. 137. pp. 323–355. DOI 10.1016/0010-8545(94)03005-B.
- ↑ A. J. Arduengo, H. V. R. Dias, R. L. Harlow, and M. Kline (1992). «Electronic stabilization of nucleophilic carbenes» J. Am. Chem. Soc.. Vol. 114. pp. 5530. DOI 10.1021/ja00040a007.
- ↑ a b W. A. Herrmann, C. Kocher, L. J. Goossen, and G. R. J. Artus (1996). «Heterocyclic Carbenes: A High-Yielding Synthesis of Novel, Functionalized N-Heterocyclic Carbenes in Liquid Ammonia» Chem. Eur. J.. Vol. 2. pp. 1627. DOI 10.1002/chem.19960021222.
- ↑ A. J. Arduengo, F. Davidson, H. V. R. Dias, J. R. Goerlich, D. Khasnis, W. J. Marshall, T. K. Prakasha (1997). «An Air Stable Carbene and Mixed Carbene "Dimers"» J. Am. Chem. Soc.. Vol. 119. n.º 119. pp. 12742. DOI 10.1021/ja973241o.
- ↑ W. A. Herrmann, M. Elison, J. Fischer, C. Kocher, and G. R. J. Artus (1996). «N-Heterocyclic Carbenes: Generation under Mild Conditions and Formation of Group 8–10 Transition Metal Complexes Relevant to Catalysis» Chem. Eur. J.. Vol. 2. pp. 772. DOI 10.1002/chem.19960020708.
- ↑ H. V. R. Dias and W. C. Jin (1994). «A stable tridentate carbene ligand» Tetrahedron Lett.. Vol. 35. pp. 1365. DOI 10.1016/S0040-4039(00)76219-8.
- ↑ a b D. Enders, K. Breuer, G. Raabe, J. Runsink, J. H. Teles, J. P. Melder, K. Ebel, and S. Brode (1995). «Preparation, Structure, and Reactivity of 1,3,4-Triphenyl-4,5-dihydro-1H-1,2,4-triazol-5-ylidene, a New Stable Carbene» Angew. Chem., Int. Ed. Engl.. Vol. 34. pp. 1021. DOI 10.1002/anie.199510211.
- ↑ J. Arduengo, J. R. Goerlich, and W. J. Marshall (1995). «A stable diaminocarbene» J. Am. Chem. Soc.. Vol. 117. pp. 11027. DOI 10.1021/ja00149a034.
- ↑ a b c M. K. Denk, A. Thadani, K. Hatano, and A. J. Lough (1997). «Steric Stabilization of Nucleophilic Carbenes» Angew. Chem., Int. Ed. Engl.. Vol. 36. pp. 2607. DOI 10.1002/anie.199726071.
- ↑ a b R. W. Alder, M. E. Blake, C. Bortolotti, S. Buffali, C. P. Butts, E. Lineham, J. M. Oliva, A. G. Orpen, and M. J. Quayle (1999). «Complexation of stable carbenes with alkali metals» Chem. Commun.. pp. 241. DOI 10.1039/a808951e.
- ↑ a b R. W. Alder, P. R. Allen, M. Murray, and A. G. Orpen (1996). «Bis(diisopropylamino)carbene» Angew. Chem., Int. Ed. Engl.. Vol. 35. pp. 1121. DOI 10.1002/anie.199611211.
- ↑ a b c R. W. Alder and M. E. Blake (1997). «Bis(N-piperidyl)carbene and its slow dimerisation to tetrakis(N-piperidyl)ethene» Chem. Commun.. pp. 1513. DOI 10.1039/a703610h.
- ↑ R. W. Alder, M. E. Blake, and J. M. Oliva (1999). «Diaminocarbenes; Calculation of Barriers to Rotation about Ccarbene-N Bonds, Barriers to Dimerization, Proton Affinities, and 13C NMR Shifts» J. Phys. Chem. a. Vol. 103. pp. 11200. DOI 10.1021/jp9934228.
- ↑ Error en la cita: El elemento
<ref>no es válido; pues no hay una referencia con texto llamadaAlderEtDAC - ↑ a b A. J. Arduengo, J. R. Goerlich and W. J. Marshall (1997). «A Stable Thiazol-2-ylidene and Its Dimer» Liebigs Annalen. Vol. 1997. n.º 2. pp. 365–374. DOI 10.1002/jlac.199719970213.
- ↑ a b R. W. Alder, C. P. Butts, and A. G. Orpen (1998). «Stable Aminooxy- and Aminothiocarbenes» J. Am. Chem. Soc.. Vol. 120. pp. 11526. DOI 10.1021/ja9819312.
- ↑ G. Bertrand, A. Igau, A. Baceiredo, and G. Trinquier (1989). «[Bis(diisopropylamino)phosphino]trimethylsilylcarbene: A Stable Nucleophilic Carbene» Angew. Chem. Int. Ed. Engl.. Vol. 28. pp. 621. DOI 10.1002/anie.198906211.
- ↑ R. Breslow (1957). «Rapid Deuterium Exchange in Thiazolium Salts» J. Am. Chem. Soc.. Vol. 79. pp. 1762. DOI 10.1021/ja01564a064.
- ↑ H. D. Haztzler (1970). «Nucleophilic 1,3-dithiolium carbenes» J. Am. Chem. Soc.. Vol. 92. pp. 1412. DOI 10.1021/ja00708a058.
H. D. Hartzler (1972). «1,3-Dithiolium carbenes from acetylenes and carbon disulfide» J. Am. Chem. Soc.. Vol. 95. pp. 4379. DOI 10.1021/ja00794a039. - ↑ Carsten Präsang, Bruno Donnadieu, and Guy Bertrand (2005). «Stable Planar Six--Electron Six-Membered N-Heterocyclic Carbenes with Tunable Electronic Properties» J. Am. Chem. Soc.. Vol. 127. n.º 29. pp. 10182–10183. DOI 10.1021/ja052987g.
- ↑ Hideo Tomioka, Eri Iwamoto, Hidetaka Itakura and Katsuyuki Hirai (2001). «Generation and characterization of a fairly stable triplet carbene» Nature. Vol. 412. pp. 626. DOI 10.1038/35088038.
- ↑ «Triplet Carbene has Long Life» Chemical & Engineering News. Vol. 79. n.º 33. pp. 11.
- ↑ Tetsuji Itoh, Yoshimaru Nakata, Katsuyuki Hirai, Hideo Tomioka (2006). «Triplet Diphenylcarbenes Protected by Trifluoromethyl and Bromine Groups. A Triplet Carbene Surviving a Day in Solution at Room Temperature» J. Am. Chem. Soc.. Vol. 128. n.º 3. pp. 957–967. DOI 10.1021/ja056575j.
Lecturas adicionales
Revisiones sobre carbenos persistentes:
- Carbene Chemistry: From Fleeting Intermediates to Powerful Reagents, (Chapter 4, Hideo Tomioka (triplet state); Chapter 5 (singlet state), Roger W. Alder) - ed. Guy Bertrand
- Reactive Intermediate Chemistry By Robert A. Moss, Matthew Platz, Maitland Jones (Chapter 8, Stable Singlet Carbenes, Guy Bertrand)
- Alder, R. W.; Blake, M. E.; Chaker, L.; Harvey, J. N.; Paolini, F. P. V.; Schütz, J. (2004). «When and How Do Diaminocarbenes Dimerize?» Angew. Chem. Int. Ed. Engl.. Vol. 43. n.º 44. pp. 5896–5911. DOI 10.1002/anie.200400654.
- R. W. Alder, in 'Diaminocarbenes: exploring structure and reactivity', ed. G. Bertrand, New York, 2002
- Herrmann, W. A.; Köcher, C. (1997). «N-Heterocyclic Carbenes» Angew. Chem., Int. Ed. Engl.. Vol. 36. n.º 20. pp. 2162–2187. DOI 10.1002/anie.199523711.
- Regitz, M. (1996). «Stable Carbenes—Illusion or Reality?» Angew. Chem., Int. Ed. Engl.. Vol. 30. n.º 6. pp. 674–676. DOI 10.1002/anie.199106741.
Categorías: Grupos funcionales | Química organometálica
Wikimedia foundation. 2010.