- Oxígeno singlete
-
 Especies reactivas del oxígeno:
Especies reactivas del oxígeno:
1: oxígeno triplete
2: oxígeno singlete
3: radical anión superóxido
4: peróxido de hidrógeno
5: radical hidroxilo.El oxígeno singlete puede referirse a:
- Oxígeno singlete (atómico), un átomo de oxígeno en un estado excitado [singlete], representado por alguna de las formas 1S o 1D, en vez del estado fundamental triplete, 3P.[1]
El oxígeno molecular singlete u oxígeno singlete, es el nombre común utilizado para la forma diamagnética del oxígeno molecular (O2), con dos electrones apareados en el orbital de energía más alta (orbital antienlazante), π* 2p. Es menos estable que el oxígeno triplete normal, 3Σg-, conteniendo una energía adicional de 22kcal/mol.[2] Debido a sus propiedades inusuales, el oxígeno singlete puede persistir durante más de una hora a temperatura ambiente, en función del entorno. Los dos estados singletes metaestables derivados de la configuración del estado fundamental son 1Δg y 1Σg-.[1]
Contenido
Diferencias del oxígeno singlete y el oxígeno triplete
Debido a las diferencias en sus capas electrónicas, el oxígeno singlete y el oxígeno triplete difieren en sus propiedades químicas.
Las reacciones con oxígeno normal (triplete) tienen mecanismos de tipo radicales libres, por lo que requieren la activación por calor para su inicio, aunque luego continúan sin dificultad por ser fuertemente exotérmicas. Ejemplo: Combustión de los alcanos.
El oxígeno singlete no es un radical sino una especie activada. Por ello no reacciona con los alcanos, pero sí con ciertos alquenos dando reacciones de adición concertada.[2]
Los efectos dañinos de la luz solar sobre muchos materiales orgánicos (polímeros, etc) a menudo se atribuyen a los efectos del oxígeno singlete.
Química Orgánica
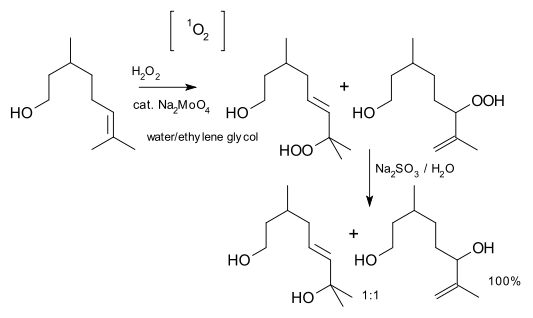
La química del oxígeno singlete[3] es diferente a la del oxígeno triplete en estado fundamental. Por ejemplo, el oxígeno singlete puede participar en reacciones de Diels-Alder y en las reacciones eno. Puede ser generado en un proceso de fotosensibilización mediante la transferencia de energía de las moléculas de colorante como rosa de bengala, azul de metileno o porfirinas, o por procesos químicos como la descomposición espontánea de trióxido de hidrógeno en el agua o la reacción del peróxido de hidrógeno con hipoclorito.[4] El oxígeno singlete reacciona con los alquenos, -C=C-CH- , por la abstracción del protón en posición alílica en una reacción de tipo reacción eno para dar hidroperóxido de alilo, HO-O-R (R = alquilo), que puede reducirse a alcohol alílico.[5] Un ejemplo es la oxigenación del citronelol[6] [note 1]
Con algunos sustratos se forman dioxetanos, y dienos cíclicos, tales como 1,3-ciclohexadieno, forman [4 + 2] aductos de cicloadición.[7]
Bioquímica
En la fotosíntesis, el oxígeno singlete puede ser producido a partir de las moléculas de clorofila captadoras de luz. Una de las funciones de los carotenoides en los sistemas fotosintéticos es prevenir el daño causado por el oxígeno singlete, eliminando el exceso de energía luminosa de las moléculas de clorofila o extinguiendo las moléculas de oxígeno singlete directamente.
En biología de mamíferos, el oxígeno singlete es una de las variedades reactivas del oxígeno, que está vinculado a la oxidación del colesterol LDL y a sus consiguientes efectos cardiovasculares. Los polifenoles antioxidantes pueden recoger y reducir las concentraciones de estas especies de oxígeno reactivo, y por tanto pueden evitar tales efectos nocivos oxidativos.[8]
La ingestión de pigmentos capaces de producir oxígeno singlete al ser activados por la luz puede producir graves efectos de fotosensibilidad de la piel. Esto es especialmente preocupante en los animales herbívoros (véase Fotosensibilidad en animales).
El oxígeno singlete es la especie activa en la terapia fotodinámica.
Estados orbitales
La teoría de orbitales moleculares predice dos estados singletes de baja excitación, O2 ((a¹Δg) y O2(b¹Σg+) (para la nomenclatura, véase el artículo sobre Símbolos de términos moleculares). Estos estados electrónicos se diferencian sólo en el espín y la ocupación de los dos orbitales degenerados πg antienlazantes del oxígeno (véase niveles de energía degenerados). El estado O2(b¹Σg+ es de muy corta vida media y se relaja rápidamente al estado excitado más bajo, O2(a¹Δg). Así, el estado O2(a¹Δg)es comúnmente conocido como oxígeno singlete. La diferencia de energía entre el estado singlete del O2 de menor energía, y el estado triplete de menor energía es de aproximadamente 11.340 kelvins (Te (a¹Δg <- X³Σg-) = 7882 cm−1 = 94.3 kJ/mol. = 22,6 kcal/mol).[4] El oxígeno molecular difiere de la mayoría de las moléculas por tener un estado fundamental triplete de capa abierta, O2(X³Σg-).
Química
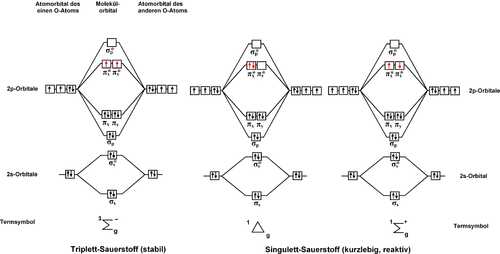 Diagramas de orbitales moleculares para las tres configuraciones electrónicas del oxígeno molecular, O2. Empezando por la izquierda, se muestran:
Diagramas de orbitales moleculares para las tres configuraciones electrónicas del oxígeno molecular, O2. Empezando por la izquierda, se muestran:
El estado fundamental triplete, ³Σg-
el estado excitado oxígeno singlete a¹Δg, y
el estado excitado oxígeno singlete b¹Σg+.
Tenga en cuenta que los estados sólo difieren en el espín y la ocupación de los dos orbitales degenerados antienlazantes πg del oxígeno.La diferencia de energía entre el estado fundamental y el estado excitado oxígeno singlete es de 94,3 kJ mol y corresponde a una transición en el infrarrojo cercano, con longitud de onda aproximada de 1270 nm. En la molécula aislada, la transición está estrictamente prohibida por las reglas de selección de espín, simetría y paridad, por lo que es una de las transiciones más prohibidas de la naturaleza. In other words, direct excitation of ground state oxygen by light to form singlet oxygen is very improbable. En otras palabras, la excitación directa por la luz del oxígeno en estado fundamental para formar oxígeno singlete es muy improbable. Como consecuencia, el oxígeno singlete en fase gaseosa tiene una vida media muy larga para corresponder a un estado excitado (72 minutos). La interacción con los disolventes, sin embargo, limita la vida media a microsegundos, o incluso a nanosegundos.[9]
La detección directa del oxígeno singlete es posible a través de su extremadamente débil fosforescencia a 1270 nm, la cual no es visible para el ojo humano. Sin embargo, a altas concentraciones de oxígeno singlete, la fluorescencia de la llamada emisión dimol[10] del oxígeno singlete (emisión simultánea por dos moléculas de oxígeno singlete en caso de colisión) puede ser observado como un resplandor rojo a 634 nm.[11]
Véase también
- Trioxígeno (Ozono), O3
- Tetraoxígeno, O4
- Octaoxígeno, O8
Enlaces externos
- The NIST webbook on oxygen
- Photochemistry & Photobiology tutorial on Singlet Oxygen
- Demonstration of the Red Singlet Oxygen Dimol Emission (Purdue University)
Notas
- ↑ reactivo: peróxido de hidrógeno, catalizador: molibdato de sodio, agente reductor: sulfito de sodio
Referencias
- ↑ a b Diccionario de química física. J. M. Costa. Ediciones Díaz de Santos, 2005. ISBN 84-7978-691-4.Pág. 420
- ↑ a b Química orgánica. Norman L. Allinger. Editorial Reverté, 1979. ISBN 84-291-7015-4. Pág. 854
- ↑ Oxígeno singlete. Ion superóxido. Parte I: Generalidades y métodos de obtención. Revista CENIC. Vol. 17-21; Centro Nacional de Investigaciones Científicas, 1986.
- ↑ a b C. Schweitzer, R. Schmidt (2003). «Physical Mechanisms of Generation and Deactivation of Singlet Oxygen». Chemical Reviews 103: pp. 1685–1757. doi:.
- ↑ Esta reacción no es realmente una reacción eno, porque no es una adición concertada: el oxígeno singlete forma un exciplex que puede ser llamado un "óxido epóxido", que luego abstrae el hidrógeno
- ↑ {{ cita revista | título = Dark Singlet Oxygenation of β-Citronellol: A Key Step in the Manufacture of Rose Oxide | autor = Paul L. Alsters, Walther Jary, Veronique Nardello-Rataj, Jean-Marie Aubry | revista = Organic Process Research & Development | año = 2009| doi = 10.1021/op900076g
- ↑ Carey, Francis A.; Sundberg, Richard J.; (1984). Advanced Organic Chemistry Part A Structure and Mechanisms (2nd ed.). New York N.Y.: Plenum Press. ISBN 0-306-41198-9.
- ↑ Cell and Molecular Cell Biology concepts and experiments Fourth Edition. Gerald Karp. Page 223 2005
- ↑ Wilkinson, F., Helman, W. P., and Ross, A. B. (1995). "Rate constants for the decay and reactions of the lowest electronically excited singlet state of molecular oxygen in solution. An expanded and revised compilation", Journal of Physical and Chemical Reference Data, 24(2): 663-677
- ↑ http://books.google.es/books?id=KrUfTWblPhMC&pg=PA117 Radiación ultravioleta y salud. Sergio Cabrera-Silva. Editorial Universitaria, 2005. ISBN 956-11-1790-8. Pág. 117
- ↑ Interpretation of the atmospheric oxygen bands; electronic levels of the oxygen molecule R.S. Mulliken Nature Volume 122, Page 505 1928
Categorías:- Sustancias oxidantes
- Espectroscopia
- Fisicoquímica
- Oxígeno
Wikimedia foundation. 2010.