- Ozono
-
Ozono



Nombre (IUPAC) sistemático Trioxígeno General Fórmula semidesarrollada O3 Fórmula molecular n/d Identificadores Número CAS 10028-15-6 Propiedades físicas Estado de agregación Gas Apariencia Azul pálido Densidad 2.140 kg/m3; 0,00214 g/cm3 Masa molar 47,998 g/mol Punto de fusión 80,7 K (-192,45 °C) Punto de ebullición 161 K (-112,15 °C) Viscosidad N/A Índice de refracción 1,2226 (liquid) Propiedades químicas Solubilidad en agua 0,105 g/100 mL (0 °C) Termoquímica ΔfH0sólido 142,3 kJ/mol S0sólido 237,7 J·mol-1·K-1 Riesgos Exposición mayor de 0,05 PPM Ingestión N/R Inhalación >0,05 PPM por 8 horas Piel No reacciona Ojos Irritación a más de 0,05 PPM Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
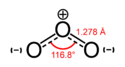
Exenciones y referenciasEl ozono (O3), es una sustancia cuya molécula está compuesta por tres átomos de oxígeno, formada al disociarse los 2 átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno (O2), formando moléculas de Ozono (O3).
A temperatura y presión ambientales el ozono es un gas de olor acre y generalmente incoloro, pero en grandes concentraciones puede volverse ligeramente azulado. Si se respira en grandes cantidades, puede provocar una irritación en los ojos y/o garganta, la cual suele pasar luego de respirar aire fresco por algunos minutos.
El ozono, es el primer alótropo de un elemento químico que fue identificado por la ciencia, Christian Friedrich Schönbein propuso que fuera un compuesto químico distinto en 1840, nombrándolo con el verbo griego ozein (ὄζειν, "tener olor"), a causa del olor peculiar que se observa durante las tormentas eléctricas.[1] [2] Recién en 1865 Jacques-Louis Soret determinó la fórmula del ozono (O3)[3] lo que fue confirmado por Schönbein en 1867.[1] [4]
Se descompone rápidamente en presencia de oxígeno a temperaturas mayores de 100 °C y en presencia de catalizadores como el dióxido de manganeso (MnO2) a temperatura ambiente. En condiciones normales, puede demorar varias en reconvertirse nuevamente en oxígeno.
Contenido
Descubrimiento
En la actualidad no se conoce quién fue su descubridor original, pero varios estudios apuntan a los químicos Charles Fabry y Henri Buisson. En mayo de 1840, el alemán Christian Schönbein lo denominó ozono, cuya raíz griega es "ozein" que significa exhalar un olor o sentir. En 1863 Soret estableció la relación entre el oxígeno y el ozono al encontrar que 3 volúmenes de oxígeno producían 2 volúmenes de ozono.
Aplicaciones
El ozono se puede producir artificialmente mediante un generador de ozono.
El ozono tiene uso industrial como precursor en la síntesis de algunos compuestos orgánicos, pero principalmente, como desinfectante (depurador y purificador). Su principal propiedad es que es un fortísimo oxidante. También es conocido por el importante papel que desempeña en la atmósfera. A este nivel es necesario distinguir entre el ozono presente en la estratosfera y el de la troposfera. En ambos casos su formación y destrucción son fenómenos fotoquímicos.
Cuando el oxígeno del aire es sujeto a un pulso de alta energía, como un rayo, el doble enlace O=O del oxígeno se rompe entregando dos átomos de oxígeno los cuales luego se recombinan con otras moléculas de oxígeno. Estas moléculas recombinadas contienen tres átomos de oxígeno en vez de dos, lo que origina ozono.
Este O3 produce la eliminación casi absoluta de olores, bacterias, virus, hongos, parásitos y otros microorganismos presentes en el aire.
Así mismo, el ozono es empleado para la purificación y desinfección del agua, eliminando tanto bacterias, como virus, algas, hongos y otros microorganismos causantes de enfermedades.
Ozono atmosférico
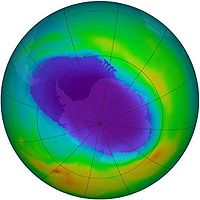
El ozono atmosférico se encuentra en estado puro en diferentes concentraciones entre los 10 y los 40 km sobre el nivel del mar, siendo su concentración más alta alrededor de los 25 km (Ozonosfera), es decir en la estratosfera.
Actúa en la atmósfera como depurador del aire y sobre todo como filtro de los rayos ultravioletas procedentes del Sol. Sin ese filtro la existencia de vida en la Tierra sería completamente imposible, de ahí la gran importancia de la llamada “Capa de Ozono”. El ozono en su forma natural es un gas de color azul y de un olor picante muy característico. Se licua a -111,9 °C y se solidifica a -193 °C.
El ozono a concentraciones del 100% es dañino para el ser humano, pero a concentraciones inferiores a los 0,05 PPM (diez partes por millón), genera beneficios para la salud, ya que a esa concentración, destruye los microorganismos patógenos del aire causantes de alergias y transmisión de enfermedades como la gripe.
La primera vez que se utilizó el ozono como terapia médica fue durante la I Guerra Mundial sobre las heridas de guerra viéndose que estas cicatrizaban mejor y más rápidamente que las tratadas con los métodos habituales de la época.
Hoy en día la ozonoterapia se practica en prácticamente todos los países tanto europeos como americanos, incluso en ciertos países como es el caso de Italia y Alemania entra dentro de las prestaciones de la Seguridad Social.
Ozono estratosférico
El ozono se encuentra de forma natural en la estratosfera, formando la denominada capa de ozono. El ozono estratosférico se forma por acción de la radiación ultravioleta, que disocia las moléculas de oxígeno molecular (O2) en dos átomos, los cuales son altamente reactivos, pudiendo reaccionar estos con otra molécula de O2 formándose el ozono.
El ozono se destruye a su vez por acción de la propia radiación ultravioleta, ya que la radiación con longitud de onda menor de 290 nm hace que se desprenda un átomo de oxígeno de la molécula de ozono. Se forma así un equilibrio dinámico en el que se forma y destruye ozono, consumiéndose de esta forma la mayoría de la radiación de longitud de onda menor de 290 nm. Así, el ozono actúa como un filtro que no deja pasar dicha radiación perjudicial hasta la superficie de la Tierra.
El equilibrio del ozono en la estratosfera se ve afectado por la presencia de contaminantes, como pueden ser los compuestos clorofluorocarbonados (CFCs), que suben hasta la alta atmósfera donde catalizan la destrucción del ozono más rápidamente de lo que se regenera, produciendo así el agujero de la capa de ozono. El daño que causan cada uno de estos contaminantes es función de su potencial de agotamiento del ozono, esto fue descubierto por los científicos Mario Molina (México), Frank Sherwood Rowland (EE.UU) y el holandés Paul J. Crutzen obteniendo por ello el Premio Nobel de Química en 1995.
Para medir la concentración de ozono en la atmósfera se utilizan instrumentos en satélites tales como GOMOS en el satélite Envisat.
Ozono troposférico
También denominado ozono ambiental. Se trata de un gas incoloro que se crea a través de reacciones fotoquímicas entre óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV) derivados de fuentes como la quema de combustible. Es el compuesto más destacado de los oxidantes fotoquímicos y forma parte del smog.
Puede encontrarse en la zona más baja de la atmósfera, ya que proviene de emisiones naturales de COV, NOx y CO, así como del ozono estratosférico descendente. Esto se convierte en un problema, puesto que el ozono, en concentración suficiente puede provocar daños en la salud humana (a partir de unos 150 microgramos por metro cúbico) o en la vegetación (a partir de unos 30 ppb (partes por billón americano)) y contribuye a generar un calentamiento en la superficie de la tierra. Estas características del ozono han propiciado que dentro de la Unión Europea aparezca una normativa relativa al ozono en el aire ambiente, que establece el nuevo régimen jurídico comunitario sobre el ozono troposférico presente en la baja atmósfera.
Su formación empieza a partir de la emisión del dióxido de nitrógeno (NO2) e hidrocarburos (compuestos que reaccionan en la presencia de calor y luz solar para producir ozono).
El mecanismo mediante el cual se genera el ozono en la troposfera es completamente distinto, ya que a esta altura no llegan las radiaciones ultravioletas. El ozono en este caso, se forma a partir de ciertos precursores (NOx - óxidos de nitrógeno; y VOCs - compuestos orgánicos volátiles, como el formaldehído), contaminantes provenientes de la actividad humana. Estos contaminantes se disocian formando radicales con radiación menos energética, y dichos radicales pueden formar ozono con el oxígeno molecular.
El conjunto del ozono, NOx y VOCs forma una neblina visible en zonas muy contaminadas denominada smog fotoquímico o smog de invierno.
Referencias
- ↑ a b Rubin, Mordecai B. (2001). «The History of Ozone. The Schönbein Period, 1839-1868» (PDF). Bull. Hist. Chem. 26 (1). http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2001-Rubin.pdf.
- ↑ «Today in Science History». Consultado el 10-05-2006.
- ↑ Jacques-Louis Soret (1865). «Recherches sur la densité de l'ozone». Comptes rendus de l'Académie des sciences 61: pp. 941. http://gallica.bnf.fr/ark:/12148/bpt6k3018b/f941.table.
- ↑ «Ozone FAQ». Global Change Master Directory. Consultado el 10-05-2006.
Véase también
- Agujero de ozono
- Capa de ozono
- Día Internacional para la Preservación de la Capa de Ozono
- Purificador de aire
- Purificador de Agua
Enlaces externos
- El ozono en ambientes de trabajo - Norma OSHA EEUU
- Phoenix Ozono - Empresa Investigadora del Ozono y fabricante de Generadores de Ozono
- Ozono estratosférico
- La Atmósfera de la Tierra
- Efectos del ozono sobre la salud, resumen realizado por GreenFacts de un informe de la OMS.
- Producción del ozono
- Producción de energía limpia, Bio-gas.
- Asociacion Argentina del ozono [1]
- Calidad del aire interior en edificios comerciales e institucionales - Norma OSHA EEUU
Categorías:- Moléculas triatómicas
- Desinfectantes
- Alótropos
- Oxígeno
- Gases de efecto invernadero
- Tratamiento del Agua
Wikimedia foundation. 2010.