- Vinílogo
-
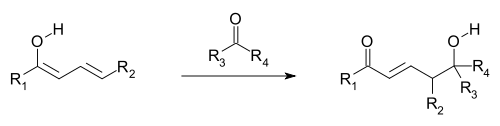
En química orgánica, la reactividad viníloga es el comportamiento de un grupo vinilo en conjugación con un grupo atractor de electrones, análoga a las reacciones del mismo grupo atractor de electrones; típicamente se trata de un grupo carbonilo. Se encuentran reacciones vinílogas cuando los orbitales π del grupo vinilo y del grupo atractor de electrones están alineados y conjugados, permitiendo al grupo atractor de electrones recibir electrones a través del sistema conjugado. Esta reactividad se observa en ácidos carboxílicos vinílogos, que tienen un grupo enol seguido y en conjugación con el grupo carbonilo, por ejemplo, en la forma enólica de la acetilacetona. Las reacciones vinílogas son, por ejemplo, adiciones conjugadas, donde el electrófilo reacciona en el grupo vinilo, y la reacción aldólica viníloga (una variante de la reacción aldólica), donde el nucleófilo atacante es un enolato vinílogo, que ataca desde su posición γ vinílica, en vez de usar su posición α como un enolato normal.
Los nucleófilos alílicos reaccionan frecuentemente por adición nucleofílica viníloga, en vez de por adición directa, esto es denominado transposición alílica.
La reactividad viníloga es explicada generalmente por deslocalización de los electrones en un sistema conjugado, donde los electrones π del enlace doble son compartidos con el par electrónico o electrones π del grupo atractor de electrones. Por ejemplo, el ácido ascórbico (vitamina C) se comporta como un ácido carboxílico vinílogo, con un enlace doble carbonílico, un enlace doble ("vinilo"), y el par libre en el grupo hidroxilo actuando como un sistema conjugado. El protón hidroxílico en el ácido ascórbico es inusualmente ácido, comparado con un grupo hidroxilo típico, debido a que dos estructuras en resonancia importantes estabilizan la carga negativa en la base conjugada del ácido ascórbico.
El término vinilogía ha sido definido para la transmisión de los efectos electrónicos a través de un sistema conjugado.[1] Este concepto fue introducido en 1926 por Ludwig Claisen, cuando explicó las propiedades acídicas de la formilacetona y β-cetoaldehídos relacionados.[2]
Referencias
- ↑ The Vinylogous Aldol Reaction: A Valuable, Yet Understated Carbon-Carbon Bond-Forming Maneuver Giovanni Casiraghi, Franca Zanardi, Giovanni Appendino, and Gloria Rassu Chem. Rev. 2000; 100(6) pp 1929 - 1972; (Review) doi 10.1021/cr990247i
- ↑ Zu den O-Alkylderivaten des Benzoyl-acetons und den aus ihnen entstehenden Isoxazolen. (Entgegnung an Hrn. O. Weygand.) Berichte der deutschen chemischen Gesellschaft (A and B Series) Volume 59, Issue 2, Date: 10. Februar 1926, Pages: 144-153 L. Claisen. doi 10.1002/cber.19260590206
Categorías:- Mecanismos de reacción
- Química orgánica
-
Wikimedia foundation. 2010.