- Sistema conjugado
-
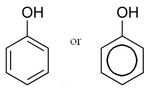
Un sistema conjugado ocurre en un compuesto químico donde los átomos unidos mediante enlace covalentemente con enlaces simples y múltiples alternantes (por ejemplo, C=C-C=C-C) y con influencia mutua para producir una región llamada deslocalización electrónica. En esta región, los electrones no pertenecen a un solo enlace o átomo, sino a un grupo. Por ejemplo, el fenol (C6H5OH) tiene un sistema de 6 electrones sobre y debajo del anillo plano, así como también del grupo hidróxilo.
El sistema conjugado resulta en una deslocalización general de los electrones a través de todos los orbitales p alineados paralelamente, lo que incrementa la estabilidad y disminuye la energía global de la molécula.[1]
Contenido
Trasfondo
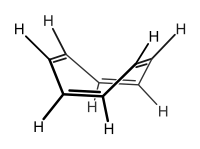
 La conjugación puede mantenerse por la presencia de diferentes tipos de grupos donantes de orbitales p. El furano es considerado un sistema conjugado por esta razón.
La conjugación puede mantenerse por la presencia de diferentes tipos de grupos donantes de orbitales p. El furano es considerado un sistema conjugado por esta razón.
La conjugación es posible por otros medios diferentes al proceso de alternación de enlaces simples y dobles. Mientras existan átomos contiguos en la cadena que posean un orbital p, el sistema puede ser considerado conjugado. Por ejemplo el furano, mostrado a la derecha, es un anillo de cinco miembros con dos dobles enlaces alternantes y un átomo de oxígeno en la posición 1. El átomo de oxígeno tienes dos pares libres, uno de los cuales ocupa un orbital p en dicha posición, manteniendo la conjugación del anillo de cinco miembros. La presencia de un átomo de nitrógeno en el anillo, o de grupos α al anillo tal como un grupo carbonilo (C=O), un grupo imina (C=N), un grupo vinilo (C=C), o un anión puede bastar como una fuente de orbitales p para mantener la conjugación.
Los sistemas conjugados tienen propiedades únicas que dan origen a color fuertes. Muchos pigmentos hacen uso de sistemas conjugados de electrones, como la larga cadena conjugada del hidrocarburo beta-caroteno, que resulta en un fuerte color naranja (de las zanahorias y otros vegetales). Cuando un electrón en el sistema absorbe un fotón de luz de longitud de onda adecuada, puede ser promovido a un nivel de energía superior. (Ver partícula en una caja). La mayoría de estas transiciones electrónicas son de un electrón de orbital π a un orbital antienlazante π*, pero también pueden participar electrones no enlazantes (p a π*). Los sistemas conjugados de menos de ochos enlaces dobles suelen absorber sólo en la región ultravioleta y son incoloros al ojo humano. Con cada enlace doble agregado, el sistema absorbe fotones de longitudes de onda más largas (y menor energía), y el compuesto está en un rango de color entre amarillo y rojo. Los compuestos que son azules o verdes generalmente no deben su color sólo a sistemas conjugados de enlaces dobles.
Esta absorción de luz en el espectro ultravioleta a visible puede ser cuantificada usando espectroscopia ultravioleta-visible, y forma la base de todo el campo de la fotoquímica.
 Estructura química del beta-caroteno. Los once enlaces dobles conjugados que forman el cromóforo de la molécula están resaltados en rojo.
Estructura química del beta-caroteno. Los once enlaces dobles conjugados que forman el cromóforo de la molécula están resaltados en rojo.
Los sistemas conjugados forman la base de los cromóforos, que son partes de una molécula que absorben la luz, y pueden ser usadas para hacer que un compuesto sea coloreado. Tales cromóforos suelen estar presentes en varios compuestos orgánicos, y algunas veces presentes en polímeros, que están coloreados o brillan en la oscuridad. Esto suele deberse a sistemas de anillos conjugados con enlaces como C=O y N=N, además de los enlaces conjugados carbono-carbono.
La conjugación en sistemas cíclicos resulta en la aromaticidad, una estabilidad inusual que se encuentra en muchos sistemas cíclicos conjugados, como el benceno y derivados, furano y pirrol.
Es importante notar que el simple hecho de poseer enlaces simples y múltiples alternantes no es suficiente para que un sistema esté fuertemente conjugado. Algunos hidrocarburos cíclicos (como el ciclooctatetraeno) poseen enlaces simples y dobles alternantes. Aunque la molécula pueda parecer planar si sólo se mira a la estructura química, no lo es realmente, y adopta una conformación típìca de "bañera". Debido a que los orbitales p de la molécula no se alínean bien en esta molécula no plana, no se comparte fácilmente entre los átomos de carbono.
Ejemplos comunes
- Vitamina D
- Vitamina A
- Vitamina B12
- Hemoglobina
- Clorofila
- Caroteno
- Benceno
Véase también
Referencias
- ↑ March Jerry; (1985). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
Wikimedia foundation. 2010.