- Óxido de mercurio (II)
-
Óxido de mercurio (II)

Nombre (IUPAC) sistemático Óxido de mercurio (II) General Otros nombres Óxido mercúrico
MontroiditaFórmula molecular HgO Identificadores Número CAS 21908-53-2 Número RTECS OW8750000 Propiedades físicas Estado de agregación Sólido Apariencia Amarillo, naranja o rojo Densidad 11140 kg/m3; 11,14 g/cm3 Masa molar n/d Punto de fusión 773 K (499,85 °C) Índice de refracción 2,5 (550 nm)[1] Propiedades químicas Compuestos relacionados Otros aniones Sulfuro de mercurio (II)
Seleniuro de mercurio (II)
Telururo de mercurio (II)Otros cationes Óxido de zinc
Óxido de cadmioOtros comptos. de Hg y O Óxido de mercurio (I) Peligrosidad NFPA 704 Frases R R26/27/28, R33, R50/53 Frases S S1/2, S13, S28, S45, S60, S61 Número RTECS OW8750000 Riesgos 

Más información ICSC 0981 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl óxido de mercurio (II), también llamado óxido mercúrico o simplemente óxido de mercurio, es un compuesto binario, cuya fórmula es HgO. Tiene un color rojo o naranja. El óxido de mercurio (II) es sólido a temperatura y presión ambientales. La forma mineral es llama montroidita y es muy rara de encontrar.
Contenido
Historia
En 1774, Joseph Priestley descubrió el oxígeno, que se liberaba por calentamiento del óxido de mercurio, aunque no identificó a este gas con el oxígeno (en su lugar, Priestley lo llamó "aire desflogisticado", ya que el flogisto era el paradigma sobre el que estaba trabajando en en ese momento).[2]
Síntesis
La forma roja del HgO se puede obtener por diversos métodos:
- Por calentamiento de Hg en atmósfera de oxígeno a aproximadamente 350 °C.

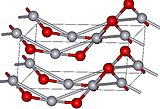 Estructura del cinabrio
Estructura del cinabrio
La forma amarilla se puede obtener por la precipitación de disoluciones acuosas de Hg2+, como las disoluciones de cloruro de mercurio (II), al ser tratadas con álcalis (como el hidróxido de sodio o el hidróxido de potasio).[3]
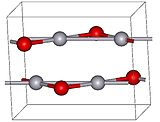
La diferencia en el color se debe al tamaño de las partículas; ambas formas tienen la misma estructura que consiste en unidades O-Hg-O casi lineales, enlazadas a cadenas en zig-zag con un ángulo O-Hg-O de 108°.[3]Estructura
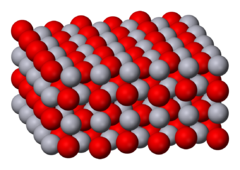
A presión atmosférica, el óxido de mercurio tiene dos formas cristalinas: una se llama montroidita (sistema ortorrómbico, 2/m 2/m 2/m, Pnma), y la segunda es análoga a la del mineral cinabrio (sistema hexagonal, hP6, P3221), estando ambas caracterizadas por las cadenas de Hg-O.[4] A presiones superiores a 10 GPa, ambas estructuras se convierten en una forma tetragonal.[1]
Usos
El HgO a veces se utiliza en la producción de mercurio, ya que se descompone con mucha facilidad. Cuando se descompone, se genera gas oxígeno.
También se utiliza como material para cátodos de baterías de mercurio.[5]
Efectos sobre la salud
Archivo:HgOlabel.jpgEtiqueta de un frasco de HgO en polvo.El óxido de mercurio (II) es una sustancia tóxica que se puede absorber por inhalación en forma de aerosol, a través de la piel y por ingestión. La sustancia irrita los ojos, la piel y el tracto respiratorio y puede tener efectos perjudiciales sobre los riñones, que provoque una insuficiencia renal. En la cadena alimentaria referida a los seres humanos tiene lugar bioacumulación, concretamente en organismos acuáticos. Por ello, la sustancia está prohibida como plaguicida por el gobierno de la UE.[6]
La evaporación a 20 °C es despreciable. El HgO se descompone al exponerse a la luz o la calefacción por encima de 500 °C. La calefacción del compuesto produce humos muy tóxicos de mercurio y oxígeno, lo que aumenta el riesgo de incendio. El óxido de mercurio (II) reacciona violentamente con agentes reductores, o con cloro, peróxido de hidrógeno, magnesio (cuando se calienta), dicloruro de diazufre y trisulfuro de hidrógeno. Se forman compuestos inestables frente al choque cuando se combina con metales y elementos como el azufre y el fósforo.[7]
Referencias
- ↑ a b «Mercury oxide (HgO) crystal structure, physical properties». 41B. Springer-Verlag. 1999. pp. 1–7. doi:. ISBN 978-3-540-64964-9.
- ↑ Almqvist, Ebbe. History of Industrial Gases. Springer. p. 23. ISBN 0306472775. http://books.google.com/?id=OI0fTJhydh4C&pg=PA23&dq=Joseph+Priestley+oxygen+mercury.
- ↑ a b c Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-08-037941-9
- ↑ «The Structure of Hexagonal Mercury(II)oxide.». Acta Chemica Scandinavica 12: pp. 1297–1304. 1958. doi:. http://actachemscand.dk/volume.php?select1=2&vol=12.
- ↑ Moore, John W.; Conrad L. Stanitski, Peter C. Jurs. Chemistry: The Molecular Science. Thomson Brooks/Cole. p. 941. ISBN 0534422012. http://books.google.com/?id=dOD4dTQ3-ZkC&pg=PA941&dq=Mercury(II)+oxide+anode+%22mercury+battery%22.
- ↑ Chemicals Regulation Directorate. «Banned and Non-Authorised Pesticides in the United Kingdom». Consultado el 1 de diciembre de 2009.
- ↑ «Mercury (II) oxide». International Occupational Safety and Health Information Centre. Consultado el 06-06-2009.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Óxido de mercurio (II). Commons
Wikimedia Commons alberga contenido multimedia sobre Óxido de mercurio (II). Commons- National Pollutant Inventory - Mercurio y sus compuestos - Hoja de seguridad (en inglés)
- Información en Webelements. (en inglés)
Categorías:- Óxidos
- Compuestos de mercurio
- Compuestos inorgánicos
Wikimedia foundation. 2010.