- Peróxido de hidrógeno
-
Peróxido de hidrógeno
Nombre (IUPAC) sistemático Agua Oxigenada General Otros nombres Agua oxigenada
DioxidanoFórmula molecular n/d Identificadores Número CAS 7722-84-1 Número RTECS MX0900000 Propiedades físicas Estado de agregación Líquido Apariencia Incoloro Densidad 1400 kg/m3; 1,4 g/cm3 Masa molar 34,0147 g/mol Punto de fusión 272.6 K (–0.4 °C) Punto de ebullición 423.35 K (150.2 °C) Estructura cristalina n/d Viscosidad 1,245 cP a 20 °C Propiedades químicas Acidez (pKa) 11,65 Solubilidad en agua Miscible KPS n/d Momento dipolar 2,26 D Compuestos relacionados Otros aniones ? Otros cationes Peróxido de sodio Compuestos relacionados Agua, ozono, hidracina Termoquímica ΔfH0gas -136,11 kJ/mol ΔfH0líquido -188 kJ/mol ΔfH0sólido -200 kJ/mol S0gas, 1 bar 232,95 J·mol-1·K-1 S0líquido, 1 bar 110 J·mol-1·K-1 Peligrosidad NFPA 704 Frases R R5, R8, R20, R22, R35 Frases S (S1),(S2),S17,S26,S28,S36,S37,S39,S45 Número RTECS MX0900000 Riesgos ¡Atención! las siguientes son indicaciónes para el peróxido de hidrógeno puro y soluciones concentradas. Ingestión Serios daños, posiblemente fatal. Inhalación Irritación severa, posiblemente fatal. Piel Agente aclarante y desinfectante. Causa ardor casi inmediatamente. Ojos Peligroso. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl peróxido de hidrógeno (H2O2), también conocido como agua oxigenada o dioxidano, es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, que por lo general se presenta como un líquido ligeramente más viscoso que ésta. Es conocido por ser un poderoso oxidante.
A temperatura ambiente es un líquido incoloro con sabor amargo. Pequeñas cantidades de peróxido de hidrógeno gaseoso se encuentran naturalmente en el aire. El peróxido de hidrógeno es inestable y se descompone lentamente en oxígeno y agua con liberación de calor. Su velocidad de descomposición puede aumentar mucho en presencia de catalizadores. Aunque no es inflamable, es un agente oxidante potente que puede causar combustión espontánea cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce.
El peróxido de hidrógeno se encuentra en bajas concentraciones (3 a 9%) en muchos productos domésticos para usos medicinales y como blanqueador de vestimentas y el cabello. En la industria, el peróxido de hidrógeno se usa en concentraciones más altas para blanquear telas y pasta de papel, y al 90% como componente de combustibles para cohetes y para fabricar espuma de caucho y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas enzimas, como la catalasa.
Contenido
Propiedades fisicoquímicas
El peróxido de hidrógeno puro (H2O2) es un líquido denso y claro, con una densidad de 1,47 g/cm3 a 0 °C. El punto de fusión es de –0,4 °C, y su punto de ebullición normal es de 150 °C.
Estereoquímica
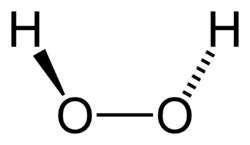
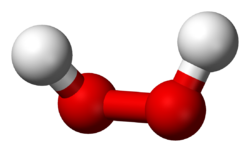
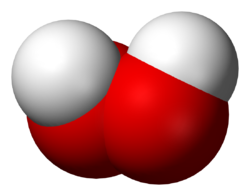
De manera similar a la del agua, el peróxido de hidrógeno presenta un eje de simetría
 (eje rotado a 180°), y además presenta tres conformaciones cis-planar (grupo de simetría C2v), cis-no planar (grupo de simetría C2) y trans-planar (grupo de simetría C2h). De ellos se ha demostrado experimentalmente que la forma espacial trans-planar es más estable que las configuraciones cis.
(eje rotado a 180°), y además presenta tres conformaciones cis-planar (grupo de simetría C2v), cis-no planar (grupo de simetría C2) y trans-planar (grupo de simetría C2h). De ellos se ha demostrado experimentalmente que la forma espacial trans-planar es más estable que las configuraciones cis.Reactividad
El peróxido de hidrógeno concentrado es una sustancia peligrosamente reactiva, debido a que su descomposición para formar agua y oxígeno es sumamente exotérmica. La siguiente reacción termoquímica demuestra ese hecho:
- 2 H2O2 (l) → 2 H2O (l) + O2 (g) ΔHº = −196,0 kJ
Rol como agente oxidante y reductor
El peróxido de hidrógeno es capaz de actuar ya sea como agente oxidante o como reductor. Las ecuaciones que se muestran a continuación presentan las semirreacciones en medio ácido:
- 2 H+ (aq) + H2O2 (aq) + 2 e− → 2 H2O (l) Eored = 1,77 V
- H2O2 (aq) → O2 (g) + 2 H+ + 2 e− Eored = 0,67 V
En solución básica, los potenciales correspondientes al electrodo estándar, son de 0,87 V para la reducción del peróxido de hidrógeno y de 0,08 V para su oxidación.
Obtención
Antiguamente el agua oxígenada era preparada por electrolisis de una solución acuosa de ácido sulfúrico o ácido de bisulfato de amonio (NH4HSO4), seguida por la hidrólisis del peroxodisulfato (SO4)2). En la actualidad el peróxido de hidrógeno se obtiene casi exclusivamente por la autoxidación de un 2-alcohol-antrahidroquinona (o 2-alco-9-10-dihidroxiantraceno) al correspondiente 2-alco antraquinona en un proceso llamado 'proceso antraquinona.
En 1994, la producción mundial de H2O2 fue de 1,9 millones de toneladas y creció hasta 2,2 millones en 2006, la mayor parte con una concentración del 70% o menos. En ese año el kilogramo de peróxido de hidrógeno se vendía a 1,5$.
Aplicaciones
Industriales
El peróxido de hidrógeno tiene muchos usos industriales, como el blanqueo de la pulpa de papel, blanqueo de algodón, blanqueo de telas y en general cada día se usa más como sustituto del cloro.
En la industria alimenticia se usa mucho para blanquear quesos, pollos, carnes, huesos, y también se usa en el proceso para la elaboración de aceites vegetales.
En la industria química se usa como reactivo, y es muy importante en la elaboración de fármacos. Se está usando también para blanqueos dentales.
Aeroespaciales
El peróxido de hidrógeno se usa en la industria aeroespacial como combustible de cohetes en motores de cohete monopropelentes o como aportación de oxígeno en motores bipropelentes. Este peróxido se usa por lo general a una concentración del 90%, y es extremadamente puro.
También se usa en concentraciones al 80% como impulsor de las turbo bombas que alimentan tanto el combustible como el oxidante en grandes motores de cohete.
Restauración de objetos de arte
El peróxido de hidrógeno se emplea en trabajos de restauración. En muchas pinturas antiguas, los pigmentos blancos a base de carbonato de plomo (II) se han decolorado debido a la formación del sulfuro de plomo (II), que posee un particular color negro. El peróxido de hidrógeno, reacciona de manera que logra convertir el sulfuro de plomo (II) a sulfato de plomo (II) (color blanco). Ambas sales son insolubles en agua. La reacción es como se muestra en la ecuación.
- PbS (s) + 4 H2O2 (aq) → PbSO4 (s) + 4 H2O (l)
Uso terapéutico
Las diluciones de peróxido de hidrógeno hasta al 6% están generalmente reconocidas como seguras por las principales agencias sanitarias del mundo para su uso como agente antimicrobiano, agente oxidante y otros propósitos. Ha sido utilizado como agente antiséptico y antibacteriano desde hace muchos años debido a su efecto oxidante. Aunque su uso ha descendido los últimos años debido a la popularidad de otros productos sustitutivos, todavía se utiliza en muchos hospitales y clínicas.
Desinfección
El peróxido de hidrógeno es un antiséptico general. Su mecanismo de acción se debe a sus efectos oxidantes: produce OH y radicales libres que atacan una amplia variedad de compuestos orgánicos, entre ellos lípidos y proteínas que componen las membranas celulares de los microorganismos. La enzima catalasa presente en los tejidos degrada rápidamente el peróxido de hidrógeno, produciendo oxígeno, que dificulta la germinación de esporas anaerobias.
Se utiliza en dermoaplicaciones, limpieza de dentaduras y desinfección bucal, así como en desinfección de lentes de contacto en el campo de la óptica.
Además, aprovechando la actividad de la peroxidasa presente en la sangre, también se usa junto a la fenolftaleína para detectar la presencia de sangre (Prueba de Kastle-Meyer).
Otros usos domésticos
- Acuarios (desinfección): el peróxido de hidrógeno (de 10 volúmenes) puede ser usado en los acuarios de peces tropicales para combatir a la Cyanobacteria, la cual muere en un plazo inferior a las 12 horas desde su aplicación incorporando 15 ml/100 L de agua.
- Acuarios (transporte de peces):
Uso como fuente de oxígeno:[1]
Si se desea transportar peces utilizando oxígeno puro embotellado en cilindros de gas se requiere de un gran desembolso de capital para la compra de tanques y otros equipos especializados. Un método práctico para el uso de peróxido de hidrógeno (agua oxigenada) en el transporte de alevines ha sido desarrollado por N. Innes Taylor y L.G Ross en el Instituto de Acuicultura de la Universidad de Stirling, Stirling FK9 4LA (Gran Bretaña). En éste método, el peróxido de hidrógeno se descompone y produce oxígeno y agua. Por lo común, el peróxido de hidrógeno se encuentra disponible en farmacias en la mayoría de los países. Aunque costoso, no se requiere de un desembolso grande de capital si cantidades pequeñas de peces van a ser transportadas. A continuación se describe éste sistema.
- Sumerja una bolsa plástica de 2 - litros de capacidad (26 centímetros x 26 centímetros) varias veces en agua limpia hasta humedecerla. Luego, sacúdala para remover el exceso de agua.
- Coloque en la bolsa 1 gramo de hígado de pescado.
- Aplaste el hígado con la mano.
- Agregue 40 mililitros de peróxido de hidrógeno con una concentración de 6% peso en volumen.
- Expulse todo el aire de la bolsa y sellela con una banda de caucho.
- Agite la bolsa para facilitar la liberación del oxígeno. La bolsa tiene que llenarse con oxígeno en aproximadamente 5 minutos.
- La bolsa de oxígeno es exprimida y el oxígeno producido es conducido a través de un tubo plástico hasta la bolsa de transporte conteniendo agua y peces. Evite exprimirla fuertemente para no forzar el líquido a la bolsa de transporte.
- Decoloración del cabello y del vello. La desventaja es que, al realizarse esto, se produce un maltrato del cuero cabelludo, y en algunos casos se debilita causando una ligera alopecia temporal.
- Limpieza y quitamanchas.
Referencias
- ↑ TRANSPORTE DE PECES, INTERNATIONAL CENTER FOR AQUACULTURE AND AQUATIC ENVIRONMENTS. AUBURN UNIVERSITY (pdf).
Véase también
Enlaces externos
- Departamento de Salud y Servicios Humanos de EE. UU., en español
- El peróxido de hidrógeno en blanqueadores dentales, resumen de un informe del CCPC
- Diagrama de flujo del peróxido de hidrógeno: esquema de producción industrial del peróxido de hidrógeno
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: ficha internacional de seguridad química del peróxido de hidrógeno
Categorías:- Antisépticos de uso tópico
- Desinfectantes
- Peróxidos
- Oxidantes para cohetes
- Compuestos de hidrógeno
- Código ATC A
- Código ATC D
Wikimedia foundation. 2010.