- Plásmido
-
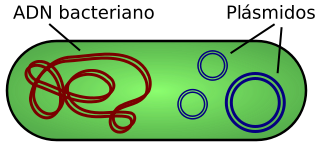
Los plásmidos, también llamados vectores, son moléculas de ADN extracromosómico circular o lineal que se replican y transcriben independientes del ADN cromosómico. Están presentes normalmente en bacterias, y en algunas ocasiones en organismos eucariotas como las levaduras. Su tamaño varía desde 1 a 250 kb. El número de plásmidos puede variar, dependiendo de su tipo, desde una sola copia hasta algunos cientos por célula. El término plásmido fue presentado por primera vez por el biólogo molecular norteamericano Joshua Lederberg en 1952.[1]
Las moléculas de ADN plásmidico, adoptan una conformación tipo doble hélice al igual que el ADN de los cromosomas, aunque, por definición, se encuentran fuera de los mismos. Se han encontrado plásmidos en casi todas las bacterias. A diferencia del ADN cromosomal, los plásmidos no tienen proteínas asociadas.
En la mayoría de los casos se considera genético dispensable. Sin embargo, posee información genética importante para las bacterias. Por ejemplo, los genes que codifican para las proteínas que las hace resistentes a los antibióticos están, frecuentemente, en los plásmidos.
Hay algunos plásmidos integrativos, es decir, que tienen la capacidad de insertarse en el cromosoma bacteriano. Estos rompen momentáneamente el cromosoma y se sitúan en su interior, con lo cual, automáticamente la maquinaria celular también reproduce el plásmido. Cuando ese plásmido se ha insertado se les da el nombre de episoma.
Los plásmidos se utilizan en ingeniería genética por su capacidad de reproducirse de manera independiente del ADN cromosomal como así también por que es relativamente fácil manipularlos e insertar nuevas secuencias genéticas.
Los plásmidos usados en Ingeniería Genética suelen contener uno o dos genes que les confieren resistencia a antibióticos y permiten seleccionar clones recombinantes. Hay otros métodos de selección además de la resistencia a antibióticos, como los basados en fluorescencia o en proteínas que destruyen las células sin uso de antibióticos. Estos nuevos métodos de selección de plásmidos son de uso frecuente en agrobiotecnología, debido a la fuerte crítica de grupos ecologistas contra la posibilidad de presencia de antibióticos en los organismos modificados genéticamente.
Contenido
Resistencia a los antibióticos
Los plásmidos a menudo contienen genes o paquetes de genes que le confieren una ventaja selectiva lo cual les da la habilidad de hacer a la bacteria, resistente a los antibióticos.
Cada plásmido contiene al menos una secuencia de ADN que sirve como un origen de replicación u ORI (un punto inicial para la replicación del ADN), lo cual habilita al ADN para ser duplicado independientemente del ADN cromosomal. Los plásmidos de la mayoría de las bacterias son circulares, pero también se conocen algunos lineales, los cuales reensamblan superficialmente los cromosomas de la mayoría de eucariotes.
Epísomas
Un epísoma es un plásmido que puede integrarse por sí mismo al ADN cromosomal del organismo huésped. Por esta razón, puede mantenerse en contacto por un largo tiempo, ser duplicado en cada división celular del huésped y volverse parte básica de su mapa genético. Este término no se usa más en plásmidos, debido a que ahora está claro que una región homologa con el cromosoma elabora un plásmido dentro de un epísoma.
Los plásmidos usados en ingeniería genética son llamados “vectores”. Estos son usados para transferir genes desde un organismo a otro y típicamente contienen un marcador genético confiriendo un fenotipo el cual puede ser seleccionado a favor o en contra. La mayoría también contienen un polivinculador o sitio de clonado múltiple (MCS), el cual es una pequeña región que contiene los sitios de restricción más comúnmente usados, permitiendo una fácil inserción de fragmentos de ADN en ese lugar.
Tipos
Una forma de agrupar plásmidos es por su habilidad de transferirse a otra bacteria. Los plásmidos conjugativos contienen “tra-genes”, los cuales ejecutan complejos procesos de conjugación, como la transferencia sexual de plásmidos a otra bacteria. Los plásmidos no-conjugativos, son incapaces de iniciar una conjugación, de allí que ellos pueden transferirse únicamente con la asistencia de los plásmidos conjugativos y lo hacen “por accidente”. Una clase intermedia de plásmidos son los “movilizables” los cuales llevan solo un subtipo de genes requeridos para la transferencia. Ellos pueden “parasitar” un plásmido conjugativo, transfiriéndose a una alta frecuencia solo en su presencia.
Es posible para plásmidos de diferentes tipos el coexistir en una celular simple.
Siete tipos diferentes de plásmidos han sido encontrados en la E.Coli. Pero normalmente plásmidos relacionados son incompatibles, en el sentido de que solo uno de ellos sobrevive en la línea celular, debido a la regulación de las funciones vitales de los plásmidos. Por lo tanto, los plásmidos pueden ser diferenciados de acuerdo a grupos de compatibilidad.
Otra forma de clasificar plásmidos es por función. Hay 5 clases principales:
- Plásmidos de fertilidad: los cuales contienen tra-genes, son capaces de conjugarse.
- Plásmidos de resistencia: los cuales contienen genes que pueden constituir resistencia contra antibióticos o venenos. Históricamente conocidos como Factores R, antes de que se entendiera la naturaleza de los plásmidos.
- Col-plásmidos: los cuales contienen genes que codifican (determinan la producción de) colinas y proteínas que pueden matar a otra bacteria.
- Plásmidos degradativos: los cuales habilitan la digestión de sustancias inusuales como tolueno o ácido salicílico.
- Plásmidos virulentos: los cuales convierten la bacteria en un patógeno.
Los plásmidos pueden pertenecer a más de uno de estos grupos funcionales.
Los plásmidos solo pueden coexistir como una o más copias en cada bacteria, debido a la división celular pueden perderse en una de las bacterias segregadas.
Algunos plásmidos incluyen un sistema de adición o “Sistema de Muerte Postsegregacional” (PSK: Postsegregational Killing System). Ellos producen en conjunto un veneno de larga vida y un antídoto de vida corta. Las células hija que retienen una copia del plásmido sobreviven, mientras que una célula hija que falla al integrar el plásmido muere o sufre una reducida tasa de crecimiento debido al veneno que obtuvo de la célula padre. Este es un ejemplo de plásmidos como el ADN replicante.
Aplicaciones
Los plásmidos sirven como una importante herramienta en laboratorios de genética e ingeniería bioquímica, donde son comúnmente usados para multiplicar (hacer muchas copias de) o como genes particulares expresos. Muchos plásmidos están disponibles comercialmente para dichos usos.
El gen a ser replicado se inserta en copias de un plásmido el cual contiene genes que hacen células resistentes a un antibiótico en particular. En el paso siguiente el plásmido es insertado en la bacteria por medio de un proceso llamado transformación. Luego, la bacteria es expuesta a un antibiótico particular. Solo la bacteria que toma copias del plásmido sobrevive al antibiótico debido a que el plásmido lo hace resistente. En particular, los genes protectores son expresados (usados para hacer proteína) y la proteína expresada evita la acción del antibiótico. De esta forma, los antibióticos actúan como un filtro que seleccionan únicamente la bacteria modificada. Ahora, estas bacterias pueden ser cultivadas en largas cantidades, cosechadas y el plásmido de interés puede ser aislado.
Otro uso importante de los plásmidos es fabricar grandes cantidades de proteínas.. En este se deja crecer la bacteria que contiene el plásmido que encierra al gen de interés. Solo como la bacteria produce la proteína que le confiere si resistencia a los antibióticos, este también puede ser usado para producir proteínas en grandes cantidades desde el gen insertado. Esta es una forma barata y fácil de producir genes o proteínas que este codifica de forma masiva, como por ejemplo insulina, o inclusive antibióticos.
Extracción del ADN plasmídico
Como se comentaba anteriormente, los plásmidos son usados a menudo para purificar una secuencia específica, debido a que ellos pueden ser fácilmente purificados del resto del genoma. Para su uso como vectores y como clonadores moleculares, a menudo los plásmidos necesitan ser aislados.
Hay muchos métodos de aislar ADN plasmídico de una bacteria, los arquetipos de los cuales son el miniprep y el maxiprep. El miniprep se suele usar desde una perspectiva analítica. El resultado es una cantidad de ADN plasmídico (10-30μg), el cual es suficiente para análisis usando digestión restrictiva, para secuenciación o para algunas técnicas de ingeniería genética.
En el maxiprep, se cultivan volúmenes mucho más grandes de bacterias en suspensión. Esencialmente este es un escalado de la preparación mini-prep, el cual es seguido por una purificación adicional. Esto resulta en una cantidad relativamente grande (0,5 -1 mg) de ADN plásmido muy puro.
En los últimos tiempos muchos kits comerciales han sido creados para realizar la extracción plasmídica a varias escalas, pureza y niveles de automatización.
Conformaciones
El ADN plásmido puede aparecer en uno de cinco conformaciones, las cuales (para un tamaño dado) corren a diferentes velocidades en un gel durante electroforesis. Las conformaciones se muestran abajo en orden de movilidad electroforética (velocidad para un voltaje dado), del más lento al más rápido:
- Mellado abierto circular: el ADN tiene un solo corte filamentario.
- Lineal: ADN tiene terminales libres, ya sea porque los filamentos fueron cortados o porque el ADN era linear in vivo. Usted puede modelar este como un cordón que no se ha conectado así mismo.
- circular relajado: ADN que interactúa completamente con ambos filamentos sin cortar, pero que ha sido enzimáticamente “relajado”. Usted puede modelar este dejando un cordón relajado y luego conectándolo a sí mismo.
- superespiral desnaturalizado: ADN como el ADN superespiral o superenrollado (ver más abajo), pero que tiene regiones sin unir que lo hacen ligeramente menos compacto; esto resulta de una excesiva alcalinidad durante la preparación del plásmido.
- ADN superespiral: Es un ADN totalmente intacto con los filamentos sin cortar, y con forma de remolino, resultando en una forma compacta.
La tasa de migración de pequeños fragmentos lineales es directamente proporcional al voltaje aplicado (en el caso de voltajes bajos). En el caso de altos voltajes, grandes fragmentos migran continuamente a diferentes tasas. Por lo tanto, la resolución del gel decrece con el incremento del voltaje.
A un bajo voltaje determinado, la migración de un pequeño fragmento lineal de ADN está en función de su longitud. Fragmentos lineales largos (de 20kb) migran a cierta tasa sin importar la longitud. Esto es debido a que las moléculas “reptan” desde el centro de la molécula siguiendo el sentido de la matriz de gel.
La digestión restrictiva se usa frecuentemente para analizar fragmentos purificados de plásmidos. Estas enzimas rompen específicamente el ADN en ciertas secuencias cortas.
Referencias
- Klein, Donald W.; Prescott, Lansing M.; Harley, John (1999). Microbiology. Boston: WCB/McGraw-Hill.
- ↑ LEDERBERG J (1952). «Cell genetics and hereditary symbiosis». Physiol. Rev. 32 (4): pp. 403-30.
Véase también
Wikimedia foundation. 2010.