- Carbonatación
-
Carbonatación
La carbonatación es un reacción química en la que el hidróxido de calcio reacciona con el dióxido de carbono y forma carbonato cálcico insoluble:
- Ca(OH)2 + CO2
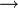 CaCO3 + H2O
CaCO3 + H2O
Hormigón
La carbonatación es un proceso lento que ocurre en el hormigón, donde la cal apagada (hidróxido cálcico) del cemento reacciona con el dióxido de carbono del aire formando carbonato cálcico. Esta reacción, necesariamente se produce en medio acuoso, ya que el dióxido de carbono reacciona con el agua formando ácido carbonico, ya que éste reaccionará con el hidróxido de calcio, obteniendo como resultado el carbonato de calcio y agua. Dado que la carbonatación provoca una bajada de pH (ácido) esto puede llevar a la corrosión de la armadura y dañar la construcción.
Refinación de azúcar
El proceso de carbonatación se usa en la producción de azúcar a partir de la remolacha azucarera. Se introduce agua de cal (hidróxido cálcico en suspensión) y gas enriquecido con dióxido de carbono en el «zumo crudo», el líquido rico en azúcar procedente de la etapa de difusión del proceso, para formar carbonato cálcico y precipitar y eliminar impurezas. Todo el proceso tiene lugar en «tanques de carbonatación» y el tiempo necesario varía de 20 minutos a una hora.
La carbonatación implica los siguientes efectos:
- El incremento de la alcalinidad coagula las proteínas del zumo.
- El carbonato cálcico absorbe los colorantes.
- La alcalinidad destruye algunos azúcares monosacáridos, principalmente glucosa y fructosa.
El objetivo es una partícula grande que se asienta rápidamente de forma natural dejando un zumo claro. Al final dicho zumo está aproximadamente a 15 °Bx y tiene un 90% de sacarosa. El pH del zumo claro producido es un equilibrio entre la eliminación del mucho calcio de la solución y la bajada de pH esperada en el proceso subsiguiente. Si el zumo se vuelve ácido en las etapas de cristalización la sacarosa se descompondrá rápidamente en glucosa y fructosa, que no sólo afectan a dicha cristalización sino que son «melazagénicas», llevándose cantidades equivalentes de sacarosa a la etapa de melaza. El pH del zumo claro obtenido puede ajustarse con sosa y la adición de azufre (sulfatación) antes de pasar a la siguiente etapa, que es la concentración mediante evaporación.
El dióxido de carbono bombeado a la mezcla forma carbonato cálcico. Los sólidos ajenos al azúcar se incorporan a las partículas de carbonato cálcico y se eliminan por sedimentación natural (o asistida) en tanques al efecto.
Hay varios sistemas de carbonatación, bautizados por las compañías que los desarrollaron originalmente. Difieren en la forma de introducir el agua de cal, las temperaturas y duraciones de cada etapa y el método de separación de sólidos del líquido.
- Dorr (también Dorr-Oliver), un proceso contínuo que usa dos tanques con reciclaje («1ª carbonatación») para aumentar el tamaño de las partículas para la floculación natural. La tasa de reciclaje es aproximadamente 7:1. Las partículas se separan por gravedad en una etapa de engrosado en un recipiente llamado «aclarador». El zumo claro se gasifica más entonces en otro tanque («2ª carbonatación») y se filtra. El lodo concentrado (sedimentos) se filtra y prensa para recuperar más líquido. El proceso Dorr requiere poco mantenimiento y mano de obra pero es vulnerable a las remolachas dañadas por hielo. Es el preferido en el Reino Unido y los Estados Unidos.
- DDS (Det Danske Sukkerfabrik, ‘la fábrica de azúcar danesa’), un proceso multietapa que implica la pre-calcificación, en la que el pH del zumo se incrementa gradualmente para iniciar la precipitación de proteínas, seguida de la adición de más agua de cal y gas. Las partículas se eliminan en cada etapa por filtrado.
- RT (Raffinière Tirlemontoise, ‘refinería de Tirlemont’), otro proceso multietapa con una fase de pre-calcificación. Las partículas también se eliminan por filtrado. Es el preferido, junto con el anterior, en las fábricas europeas.
Véase también
- Fosfatación, un proceso parecido usado en la refinación del azúcar de caña.
Categorías: Industria de alimentos | Reacciones inorgánicas - Ca(OH)2 + CO2
Wikimedia foundation. 2010.
