- Fotoquímica
-
Fotoquímica
La fotoquímica, una subdisciplina de la química, es el estudio de las interacciones entre átomos, moléculas pequeñas, y la luz (o radiación electromagnética).
La primera ley de la fotoquímica, conocida como la ley de Grotthus-Draper (por los químicos Theodor Grotthuss y John W. Draper), establece que la luz debe ser absorbida por una sustancia química para que dé lugar a una reacción fotoquímica.
La segunda ley de la fotoquímica, la ley de Stark-Einstein, establece que para cada fotón de luz absorbido por un sistema químico, solamente una molécula es activada para una reacción fotoquímica. Esto es también conocido como la ley de la fotoequivalencia y fue derivada por Albert Einstein en el momento en que la teoría cuántica de la luz estaba siendo desarrollada.
La fotoquímica puede ser introducida como una reacción que procede con la absorción de luz. Normalmente, una reacción (no sólo una reacción fotoquímica) ocurre cuando una molécula gana la energía de activación necesaria para experimentar cambios. Un ejemplo de esto es la combustión de la gasolina (un hidrocarburo) en dióxido de carbono y agua. Esta es una reacción química en la que una o más moléculas o especies químicas se transforman en otras. Para que esta reacción se lleve a cabo debe ser suministrada energía de activación. La energía de activación es provista en la forma de calor o una chispa. En el caso de las reacciones fotoquímicas, es la luz la que provee la energía de activación.
La absorción de un fotón de luz por una molécula reactiva puede además permitir que ocurra una reacción no sólo llevando la molécula a la energía de activación necesaria, sino también cambiando la simetría de la configuración electrónica de la molécula, permitiendo un camino de reacción de otra forma inaccesible, tal como lo describen las reglas de selección de Woodward-Hoffman. Una reacción de cicloadición de 2+2 es un ejemplo de una reacción pericíclica que puede ser analizada utilizando estas reglas o por la relacionada teoría del orbital molecular.
Principales conceptos
Los pilares de la fotoquímica son la espectroscopía UV, reacciones fotoquímicas en química orgánica y fotosíntesis en bioquímica.
Otros términos importantes para la fotoquímica son: Fotones, absorción y emisión (transiciones electrónicas), el principio de Franck-Condon, los niveles de energía, el espín, la conversión interna, el efecto fotoeléctrico y el efecto Compton.
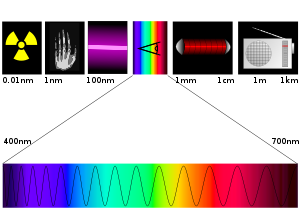
Regiones del espectro electromagnético
El espectro electromagnético es amplio, sin embargo, un fotoquímico se encontrará trabajando con algunas regiones clave. Algunas de las secciones más ampliamente usadas del espectro electromagnético incluyen:
- Luz Visible: 400-700 nm
- Ultravioleta: 100-400 nm
- Infrarrojo cercano: 700-1000 nm
- Infrarrojo lejano: 15-1000 µm
Reacción fotoquímica
En la reacción fotoquímica o reacción inducida por la luz, generalmente la luz actúa produciendo radicales libres en las moléculas, como HO o CH. Estas reacciones son típicas de la atmósfera, teniendo un papel importante en la formación de contaminantes secundarios a partir de gases emitidos por combustiones y actividades humanas, como los óxidos de nitrógeno (NOx) y los hidrocarburos. Otro interés de estas reacciones radica en su potencial uso en la oxidación de materia orgánica presente en aguas contaminadas (POA, o Procesos de oxidación avanzada), donde se emplean oxidantes tales como agua oxigenada u ozono, luz ultravioleta y dióxido de titanio como catalizador.
Categoría: Fotoquímica
Wikimedia foundation. 2010.