- Complejo de dihidrógeno
-
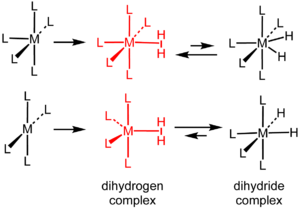 Formación y estructuras en equilibrio de los complejos metálicos de dihidrógeno y dihidruro (L = ligando).
Formación y estructuras en equilibrio de los complejos metálicos de dihidrógeno y dihidruro (L = ligando).
Los complejos de dihidrógeno son complejos de coordinación que contienen H2 intacto como ligando.[1] El complejo prototípico es W(CO)3(P(Cy)3)2(H2). Esta clase de compuestos representan intermediarios en las reacciones catalizadas por metales que involucran hidrógeno. Se ha reportado cientos de complejos de dihidrógeno. La mayoría de ejemplo son complejos de metales de transición con geometría molecular octaédrica.
Con la complejación, el enlace H-H se extiende a 0.81-0.82 Å, como se indica por difracción de neutrones, una extensión de aproximadamente 10% en relación al enlace H-H en el H2 libre. Algunos complejos contienen ligandos de hidrógeno libres, polihidruros, que también exhiben contactos H-H. Se ha sugerido que las distancias < 1.00 Å indican un carácter significativo de dihidrógeno, mientras que las separaciones > 1.00 Å son descritas mejor como complejos de dihidruro (ver figura).
Contenido
Caracterización
El método preferido para la caracterización de los complejos de dihidrógeno es la difracción de neutrones. Los neutrones interactúan fuertemente con los átomos de hidrógeno, lo que permite inferir su ubicación en un cristal. En algunos casos, los ligandos de hidrógeon se pueden caracterizar por cristalografía de rayos X, pero frecuentemente la presencia de metales, que dispersan fuertemente a los rayos X, complican el análisis. Las técnicas de RMN también son ampliamente usadas. La magnitud del acoplamiento spin-spin es un indicador útil de la fuerza del enlace entre el hidrógeno y el deuterio en complejos de HD.
Síntesis
Dos métodos de preparación involucran la reacción directa con gas H2. El primero implica la adición de H2 a un centro metálico insaturado, como se reportó originalmente para W(CO)3(P-i-Pr3)2(H2). En algunos casos, el H2 desplazará ligantes débilmente unidos, incluso halogenuros en casos favorables:
- LnMX + H2 → [LnM(H2)]+ + X-
Muchos hidruros metálicos pueden ser protonados para producir los complejos de dihidrógeno:
- LnM-H + H+ → [LnM(H2)]+
En tales casos, el ácido suele ser derivado de un anión débilmente coordinante.
Historia
En 1984, Kubas et al. descubrieron que la adición de H2 a especies de color púrpura M(CO)3(PR3)2 producía un precipitado amarillo de mer-trans- M(CO)3(PR3)2(H2) (M = Mo o W; R = ciclohexilo, isopropilo).[2] Esto condujo rápidamente al descubrimiento de una variedad de complejos relacionados, como el Cr(H2)(CO)5[3] y el [Fe(H2)(H)(dppe)2]+.[4] Los hallazgos de Kubas et al. condujeron a una reevaluación de compuestos previamente descritos. Por ejemplo, el complejo "RuH4(PPh3)3", descrito en 1968, fue reformulado como un complejo de dihidrógeno.
Referencias
- ↑ Kubas, Gregory J. (31-08-2001). Metal Dihydrogen and σ-Bond Complexes - Structure, Theory, and Reactivity (1 edición). Springer. ISBN 0306464659.
- ↑ Kubas, G. J.; R. R. Ryan, B. I. Swanson, P. J. Vergamini, H. J. Wasserman (01-01-1984). «Characterization of the first examples of isolable molecular hydrogen complexes, M( CO)3(PR3)2(H2) (M = molybdenum or tungsten; R = Cy or isopropyl). Evidence for a side-on bonded dihydrogen ligand». Journal of the American Chemical Society 106 (2): pp. 451-452. doi:. http://dx.doi.org/10.1021/ja00314a049.
- ↑ Sweany, Ray L. (01-04-1985). «Photolysis of hexacarbonylchromium in hydrogen-containing matrixes: evidence of simple adducts of molecular hydrogen». Journal of the American Chemical Society 107 (8): pp. 2374-2379. doi:. http://dx.doi.org/10.1021/ja00294a030.
- ↑ Morris, Robert H.; Jeffery F. Sawyer, Mahmoud Shiralian, Jeffrey Zubkowski (1985). «Two molecular hydrogen complexes: trans-[M(η2-H2)(H)(PPh2CH2CH2PPh2)2BF4 (M = Fe, Ru). The crystal structure determination of the iron complex]». Journal of the American Chemical Society 107 (19): pp. 5581-5582. doi:. http://dx.doi.org/10.1021/ja00305a071.
Lecturas complementarias
- Burdett, J. K.; O. Eisenstein, S. A. Jackson (06-12-1991). «Transition Metal Didydrogen Complexes: Theoretical Studies». Transition Metal Hydrides. Wiley-VCH. pp. 149–184. ISBN 0471187682.
- Burdett, Jeremy K.; John R. Phillips, Mohammad R. Pourian, Martyn Poliakoff, James J. Turner, Rita Upmacis (1987). «Electronic stability of metal-dihydrogen and polyhydrogen complexes». Inorganic Chemistry 26 (18): pp. 3054-3063. doi:. http://dx.doi.org/10.1021/ic00265a026.
- Lyons, David; Geoffrey Wilkinson, Mark Thornton-Pett, Michael B. Hursthouse (1984). «Synthesis, X-ray crystal structure, and reactions of dihydridopentakis(trimethylphosphine)molybdenum(II): crystal structure of the carbon dioxide insertion product, (formato-O,O')hydridotetrakis(trimethylphosphine)molybdenum(II)». Journal of the Chemical Society, Dalton Transactions (4): pp. 695-700. http://dx.doi.org/10.1039/DT9840000695.
- Kubas, G. J.; R. R. Ryan (1986). «Activation of H2 and SO2 by Mo and W complexes: first examples of molecular-H2 complexes, SO2 insertion into metal-hydride bonds, and homogeneous hydrogenation of SO2». Polyhedron 5 (1-2): pp. 473-485. doi:. http://www.sciencedirect.com/science?_ob=GatewayURL&_method=citationSearch&_uoikey=B6TH8-430XDT8-2N&_origin=SDEMFRASCII&_version=1&md5=d553eaf170ce2410f4339e0d461c8a21.
- Crabtree, Robert H.; Maryellen Lavin (1985). [IrH2(H2)2L2]+{L = P(C6H11)3}: A non-classical polyhydride complex. pp. 1661-1662. http://dx.doi.org/10.1039/C39850001661. Consultado el 2009-05-02.
Wikimedia foundation. 2010.
