- Hapticidad
-
El término hapticidad se usa para describir cómo un grupo de átomos contiguos de un ligando está coordinado a un átomo central. La hapticidad de un ligando se indica por la letra griega 'eta', η. El número en superíndice que sigue a η denota el número de átomos contiguos del ligando que están unidos al metal. En general, la notación η se usa sólo cuando hay más de un átomo coordinado (en caso contrario, se usa la notación κ, correspondiente a denticidad).
Contenido
Historia
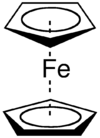
La necesidad de nomenclatura adicional para los compuestos organometálicos se hizo aparente a mediados de la década de 1950, cuando Dunitz, Orgel y Rich describieron la estructura del complejo "sandwich" ferroceno por cristalografía de rayos X[1] donde un átomo de hierro está convertido en un "sándwich" entre dos anillos paralelos de ciclopentadienilo. Posteriormente, Cotton propuso el término hapticidad, derivado del prefijo adjetivo hapto (del griego haptein, ajustar, denotando contacto o combinación) colocado antes del nombre de la olefina,[2] donde la letra griega η (eta) es usada para denotar el número de átomos contiguos de un ligando que se une a un centro metálico. El término suele ser empleado para describir ligandos conteniendo sistemas π extendidos o donde una interacción agóstica no es obvia en la fórmula.
Compuestos históricamente importantes donde los ligandos están descritos con hapticidad
- Ferroceno - bis(η5-ciclopentadienil)hierro
- Uranoceno - bis(η8-1,3,5,7-ciclooctatetraeno)uranio
- W(CO)3(PPri3)2(η2-H2 ) - el primer compuesto en ser sintetizado con un ligando dihidrógeno.[3] [4]
- IrCl(CO)[P(C6H5)3]2(η2-O2) - el derivado de dioxígeno que se forma reversiblemente por la oxigenación del complejo de Vaska.
Ejemplos
La notación η se encuentra en muchos compuestos de coordinación:
- Moléculas enlazadas lateralmente conteniendo enlaces σ, como H2:
- Ligantes enlazados lateralmente, conteniendo átomos con enlaces múltiples, como el etileno en la sal de Zeise, que está unido a través de la donación de los electrones de enlace π:
-
- Observe que con algunos ligandos puente, se observa un modo de puente alternativo, el κ1,κ1, como en (Me3SiCH2)3V(μ-N2-κ1(N),κ1(N'))V(CH2SiMe3)3 contiene una molécula de dinitrógeno puente, donde la molécula está coordinada en un extremo a los dos centros metálicos.
- El enlace de especies con enlace π puede extenderse sobre varios átomos, como en los ligandos alilo, butadieno, pero también en anillos de ciclopentadienilo o benceno pueden compartir sus electrones.
- Algunas violaciones aparentes a la regla de los 18 electrones son explicables en compuestos con hapticidades inusuales:
- El complejo de 18 electrones de valencia (η5-C5H5)Fe(η1-C5H5)(CO)2 contiene un ciclopentadienilo enlazado en η5, and un ciclopentadienilo enlazado en η1.
- Reducción del compuesto de 18 electrones de valencia: [Ru(η6-C6Me6)2]2+ (donde los anillos aromáticos están unidos en una coordinación η6), resulta en otro compuesto de 18 electrones: [Ru(η6-C6Me6)(η4-C6Me6)].
- Ejemplos de anillos inorgánicos y heterocíclicos coordinados en polihapto:
El Cr(η5-C4H4S)(CO)3 contiene el heterociclo de azufre tiofeno y el Cr(η6-B3N3Me6)(CO)3 contiene un anillo inorgánico coordinado (B3N3 ring).
Electrones donados por "ligandos π" vs. hapticidad
Ligando Electrones
contribuidos
(conteo neutral)Electrones
contribuidos
(conteo iónico)η1 Alilo 1 2 η3-Alilo
ciclopropenilo3 4 η3-Enilo 3 4 η2-Butadieno 2 2 η4-Butadieno 4 4 η1-ciclopentadienilo 1 2 η3-ciclopentadienilo 3 4 η5-ciclopentadienilo
pentadienilo
ciclohexadienilo5 6 η2-Benceno 2 2 η4-Benceno 4 4 η6-Benceno 6 6 η7-Cicloheptatrienilo 7 6 η8-Ciclooctatetraenilo 8 10 Referencias
- ↑ J. Dunitz, L. Orgel, A. Rich (1956). «The crystal structure of ferrocene». Acta Crystallographica 9: pp. 373–5. doi:.
- ↑ F. A. Cotton (1968). «Proposed nomenclature for olefin-metal and other organometallic complexes». J. Am. Chem. Soc. 90 (22): pp. 6230–6232. doi:.
- ↑ a b G. J. Kubas (1988). «Molecular hydrogen complexes: coordination of a σ bond to transition metals». Acc. Chem. Res. 21 (3): pp. 120–128. doi:.
- ↑ a b Kubas, G. J., "Metal Dihydrogen and σ-Bond Complexes", Kluwer Academic/Plenum Publishers: New York, 2001
- ↑ D. Sutton (1993). «Organometallic diazo compounds». Chem. Rev. 93 (3): pp. 995–1022. doi:.
Wikimedia foundation. 2010.